A sähköpallo on atomin alue, jossa elektronit Ne sijaitsevat. Elektrosfääri, tarkemmin sanottuna, koostuu atomikiertoradoista, jotka määritetään ratkaisemalla Schrödingerin yhtälö. Ensin Rutherfordin mallilla määritetty elektropallo saavutti merkittäviä edistysaskeleita Bohrin atomimallin voimassaolon aikana.
Elektrosfääri voidaan jakaa kerroksiin (tai energiatasoihin), koska elektroneilla on määritelty (epäjatkuva) energia. Atomilla, joissa on kaksi tai useampia elektroneja, kuoret jakautuvat osakuoriksi (tai osakuoriksi). Elektrosfääri on erittäin tärkeä atomin ominaisuuksien ymmärtämiseksi ja kemiallisten sidosten muodostumisen ymmärtämiseksi.
Lue myös: Miten atomi jakautuu?
Tämän artikkelin aiheet
- 1 - Yhteenveto elektropallosta
- 2 - Videotunti elektrosfääristä
- 3 - Mikä on elektrosfääri?
- 4 - Elektropallon kerrokset
- 5 - Elektropallon toiminta
- 6 - Elektrosfäärin ja atomirakenteen välinen suhde
- 7 - Ratkaistiin sähköpallon harjoituksia
Yhteenveto elektrosfääristä
Elektrosfääri on atomin alue, jossa elektronit sijaitsevat.
Se koostuu atomiorbitaaleista, aaltofunktioista, jotka ovat ratkaisuja Schrödingerin yhtälöihin.
Sen konsepti alkoi Ernest Rutherfordin mallista.
Elektronit pysyvät sähköpallossa johtuen niiden vetovoimasta atomin ytimeen.
Suurin edistysaskel sähköpallon ymmärtämisessä tapahtui Niels Bohrin mallin suunnittelun aikana.
Se koostuu kerroksista (tai energiatasoista), jotka ovat määritellyn energian alueita.
Atomilla, joissa on useampi kuin yksi elektroni, kuoret jakautuvat osakuoriksi (tai osakuoriksi).
Elektrosfääri on tärkeä useiden ominaisuuksien, kuten atomien samankaltaisuuden, stabiilisuuden, atomisäde, ionisaatioenergia, elektroniaffiniteetti, sidosten muodostumisen ymmärtämisen lisäksi kemikaalit.
Videotunti elektrosfääristä
Mikä on elektrosfääri?
Elektrosfääri määritellään seuraavasti atomirakenteen alue, jossa elektronit sijaitsevat. Syvemmissä tulkinnoissa sanomme, että se koostuu atomiorbitaaleista, aaltofunktioista, jotka ovat ratkaisuja Schrödingerin yhtälöön. Atomiradan matemaattinen lauseke neliötettynä esittää elektronin sijainnin todennäköisyystiheyden tietyssä pisteessä.
O Sähköpallon käsite alkoi ilmaantua Ernest Rutherfordin atomimalli, jossa elektronit kiertävät tiheän, positiivisen ytimen ympärillä. Myöhemmin Niels Bohr toi merkittävämpiä tulkintoja sähköpallosta sekoittamalla kvanttimekaniikan käsitteitä.
Älä nyt lopeta... Mainonnan jälkeen on muutakin ;)
Elektrosfäärin kerrokset
Elektronit pysyvät sähköpallossa johtuen niiden vetovoimasta atomin ytimeen. Tiedetään kuitenkin, että nämä elektronit ovat kuorissa, joiden energiat ovat hyvin määriteltyjä. Tällaisia kerroksia voidaan kutsua myös energiatasoksi.
Tämä johtopäätös tuli spektroskopiakokeiden jälkeen. Esimerkiksi kun kaasuun H syötetään sähkövirtaa2 Alhaisessa paineessa valoa säteilee H2. Tässä tilassa muodostuu H-ioneja+ ja elektroneja, jotka palaavat H-ioneiksi+ ja muodostavat virittyneitä (energiaisia) H-lajeja+. Ylimääräisen energian poistamiseksi H-ionit+ vapauttaa energiaa sähkömagneettisen säteilyn (valon) muodossa ja yhdistyy uudelleen H-kaasuksi2 uudelleen.
Saatat muistaa, että kun valkoinen valo kulkee prisman läpi, se hajoaa jatkuvaksi spektriksi (sateenkaaren tapaan); sama ei kuitenkaan tapahdu H: stä tulevan valon kanssa2: kun tällainen säteily kulkee prisman läpi, H-emissiospektrissä havaitaan vain kirkkaita viivoja tietyllä aallonpituudella2, joka tunnetaan spektriviivoina.
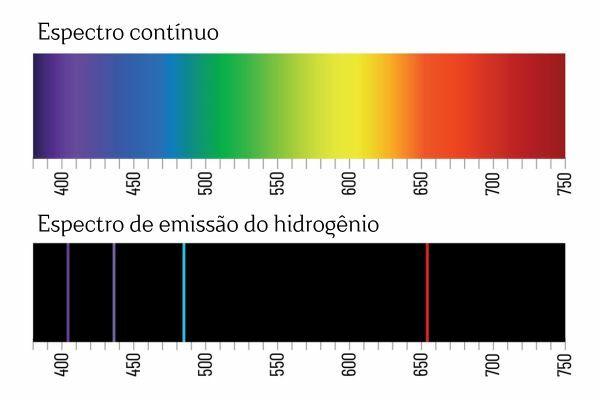
Alkuaineiden emissiospektrien tulkinta (jossa on hyvin määritellyt spektriviivat) on, että elektroni, atomissa, ei voi esittää mitään energiaa, vaan pikemminkin hyvin määriteltyinä määrinä (ns. energiapaketit). Jos elektroneilla ei olisi tällaisia energiarajoituksia, elementtien emissiospektri olisi jatkuva, aivan kuten prisman läpi kulkevan valkoisen valon.
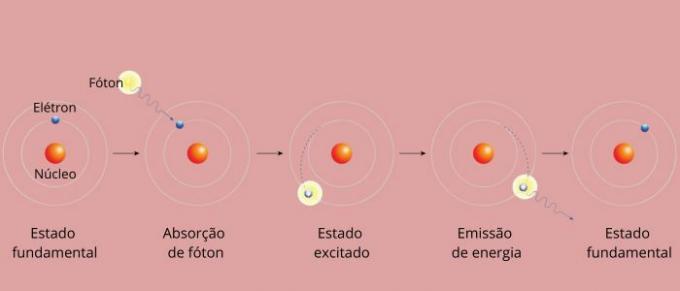
Elementin jokainen spektriviiva tunnettiin energiatasona. (tai kerros, kuten olemme enemmän tottuneet sanomaan). Nämä viivat syntyvät, kun elektroni siirtyy yhdeltä sallitulta energiatasolta toiselle energianmuutosprosessissa, joka tunnetaan elektronisena siirtymänä.
Elektronisen siirtymän aikana elektroni siirtyy alemmalta energiatasolta korkeammalle energiatasolle. Palattuaan alkutasolle se lähettää ylimääräistä energiaa sähkömagneettisen säteilyn (valo) kautta antaen alkupiste spektriviivalle, jonka emittoitu energiaarvo on verrannollinen yhtälön määrittelemään arvoon Rydberg.
Johannes Rydberg oli ruotsalainen spektroskopisti, joka loi yhtälön spektrilinjojen trendin määrittelemiseksi sveitsiläisen professorin Johann Balmerin työn pohjalta. Kunkin kerroksen ominaisenergia määritellään ratkaisemalla sopiva Schrödinger-yhtälö.
Jokaisessa elektronikerroksessa on sallittu määrä elektroneja. Tällä hetkellä on määritelty seitsemän elektronista kerrosta, jotka on merkitty kirjaimilla K - Q, aakkosjärjestyksessä tai kirjaimella n, jossa n ≥ 1. Siten kerros K on kerros, jossa n = 1 ja niin edelleen. Kuorta kohti sallittu elektronien määrä on esitetty seuraavassa taulukossa.
Energiataso |
Kerros |
Elektronien enimmäismäärä |
1 |
K |
2 |
2 |
L |
8 |
3 |
M |
18 |
4 |
N |
32 |
5 |
O |
32 |
6 |
P |
18 |
7 |
K |
8 |
Hydrogenoidiatomeille (vain 1 elektronilla, kuten H, He+, Li2+), kaikilla atomikiertoradoilla on sama energia (kutsumme niitä rappeutuneiksi kiertoradoiksi); kuitenkin atomeissa, joissa on kaksi tai useampia elektroneja, syntyy erittäin tärkeä vaikutus, elektroni-elektroni hylkiminen. Tämän tosiasian seurauksena kunkin kerroksen kiertoradalla alkaa olla eri energiat ja siksi kerroksia aletaan kuvata alikerroksina (tai alitasoina).
Nykyisten atomien kukin kerros voidaan hajottaa jopa neljään alatasoon, jota edustavat kirjaimet "s" (englanniksi, terävä), "p" (englanniksi, pää), "d" (englanniksi, diffuusio) ja "f" (englanniksi, perustavanlaatuinen).
Jokainen alataso tukee maksimimäärää elektroneja, jotka on määritelty laskelmilla ja kokeilla. "s"-alitaso tukee jopa 2 elektronia; "p"-alitaso, enintään 6 elektronia; "d"-alitaso, enintään 10 elektronia; ja "f"-alataso, jopa 14 elektronia. K-kerros on ainoa, joka sallii vain yhden kiertoradan ja siksi sillä on vain yksi alitaso.
Energiataso |
Kerros |
Alatasot |
1 |
K |
1s |
2 |
L |
2s, 2p |
3 |
M |
3s, 3p, 3d |
4 |
N |
4s, 4p, 4d, 4f |
5 |
O |
5s, 5p, 5d, 5f |
6 |
P |
6s, 6p, 6d |
7 |
K |
7s, 7p |
Elektrosfäärin toiminta
Jokaisen atomin elektropallo voidaan käyttää selittämään atomin erilaisia ominaisuuksia ja käyttäytymistä.
Ominaisuuksilla, kuten atomisäde, ionisäde, ionisaatioenergia ja elektroniaffiniteetti, on arvot, jotka ovat suoraa seurausta sähköpallon elektronisesta konfiguraatiosta, tarkemmin sanottuna nimeltään valenssikuori, joka on itse asiassa atomin tai ionin uloin elektroninen kuori.
A Samankaltaisuus jaksollisen järjestelmän saman ryhmän atomien välillä on myös seurausta elektronisesta konfiguraatiosta valenssikuoresta. Kemiallisissa prosesseissa valitsemme atomeja samasta ryhmästä jaksollisesta taulukosta mahdollisimman paljon substituentteja, ja tämä on vain uskottavaa, koska näillä atomeilla on sama elektroninen konfiguraatio kerroksessa valenssista.
Kohteeseen kemialliset sidokset, joita esiintyy atomien välillä muodostaen ionisia ja kovalenttisia yhdisteitä (molekyylejä), esiintyy myös atomien sähköpallojen välisten vuorovaikutusten kautta.
Lue myös: Schrödingerin atomimalli — tapa kuvata atomi kvanttimekaniikan avulla
Elektrosfäärin ja atomirakenteen välinen suhde
Kuten todettiin, sähköpallo käsittää atomin alueen, josta elektronit löytyvät. Tarkemmin sanottuna elektronit sijaitsevat atomikiertoradoilla, joiden energia on määritelty kvanttilaskentamilla.
Elektrosfääri on atomirakenteen suurin alue, koska atomin ydin on hyvin pieni. Ajatellessa atomia jalkapallostadionina, ydin vastaisi kentän keskellä olevaa palloa, kun taas muu stadionin osa olisi sähköpalloa.
Kuitenkin, massan suhteen sähköpallolla on vähän vaikutusta. Koska elektronien massa on noin 1836 kertaa pienempi kuin protonien ja neutronien, voidaan sanoa, että lähes kaikki atomin massa on keskittynyt ytimeen.
Ratkaistiin harjoituksia elektrosfäärillä
Kysymys 1
(Facisb 2023) Bohrin vetyatomimallissa elektroni voi miehittää vain tietyt kiertoradat. Jotkut näistä kiertoradoista on esitetty kuvassa, jossa n viittaa energiatasoihin, jotka elektronilla on kullakin kiertoradalla.
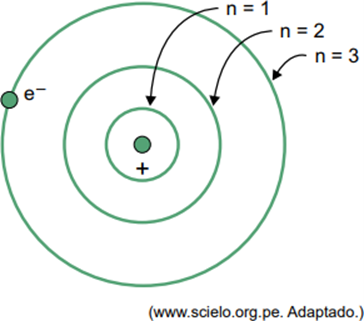
Oletetaan, että vetyatomissa elektroni on kiertoradalla, jossa n = 5.
Bohrin mallin mukaan tämä elektroni lähettää energiaa sähkömagneettisen säteilyn muodossa vain silloin, kun
(A) tee siirtymä kiertoradalle, jossa n on 6.
(B) jäävät kiertoradalle, jossa n = 5.
(C) siirtyminen mille tahansa kiertoradalle, jolla n on suurempi kuin 5.
(D) siirtyminen mille tahansa kiertoradalle, jolla n on pienempi kuin 5.
(E) irtoaa atomista ionisoimalla sen.
Vastaus: D-kirjain
Kun elektroni on ulkokuoressa, palattuaan sisäkuoreen pienemmällä energialla se vapauttaa ylimääräistä energiaa sähkömagneettisen säteilyn (valon) muodossa. Siksi valon esiintyminen tapahtuu vain, kun elektroni, joka on läsnä n = 5:ssä, siirtyy sisäkuoreen.
Kysymys 2
(Uerj 2019) Viime aikoina tutkijat onnistuivat tuottamaan metallista vetyä puristamalla molekyylivetyä korkeassa paineessa. Tämän elementin metalliset ominaisuudet ovat samat kuin muiden jaksollisen luokitustaulukon ryhmän 1 elementtien.
Tämä samankaltaisuus liittyy näiden elementtien energisimpään alatasoon, joka vastaa:
(A) ns1
(B) n.p.2
(C) ei3
(D) nf4
Vastaus: A-kirjain
Vetyatomilla on vain yksi elektroni, joka sijaitsee ensimmäisellä tasolla, alitasolla "s" (1s1). Yksi syy siihen, miksi se löytyy jaksollisen järjestelmän ryhmästä 1, on se, että kaikissa muissa tämän ryhmän kemiallisissa alkuaineissa on atomeja, joiden valenssikuori on samaa tyyppiä (ns1). Siksi samanlaisen valenssikerroksen ansiosta vetyä pystyttiin tuottamaan tässä metallimuodossa.
Lähteet:
DO CANTTO, E. L.; LEITE, L. L. W.; CANTO, L. W. Kemia – jokapäiväisessä elämässä. 1. toim. São Paulo: Moderni, 2021.
ATKINS, P.; JONES, L.; LAVERMAN, L. Kemian periaatteet: Elämän ja ympäristön kyseenalaistaminen. 7. toim. Porto Alegre: Bookman, 2018.
ATKINS, P.; DE PAULA, J.; KEELER, J. Atkinsin fysikaalinen kemia. 11 ed. Oxford: Oxford University Press, 2018.
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
NOVAIS, Stéfano Araújo. "Elektrosfääri"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/eletrosfera.htm. Käytetty 10.11.2023.


