Osmoosi on veden liike, joka tapahtuu solujen sisällä puoliläpäisevän kalvon läpi.
Tässä prosessissa vesimolekyylit siirtyvät vähemmän väkevästä väliaineesta väkevämpään väliaineeseen.
Siksi osmoosi palvelee kalvon molempia puolia tasapainottaen aiheuttaen liuenneella aineella, joka on vesi, laimennetun rikkaan väliaineen.
Kuinka osmoosi tapahtuu?
Osmoosia pidetään passiivisena kuljetuksena, kuten kalvon läpi kulkevassa liikenteessä energiaa ei hukata.
Osmoosiprosessissa vedellä, joka on liuotin, on taipumus ylittää puoliläpäisevä membraani liuoksen konsentraation tasapainottamiseksi. Tämä toimenpide suoritetaan, kunnes osmoottinen paine on vakiintunut.
Siksi vesi siirtyy vähemmän väkevältä alueelta väkevämmälle luonnollisesti.
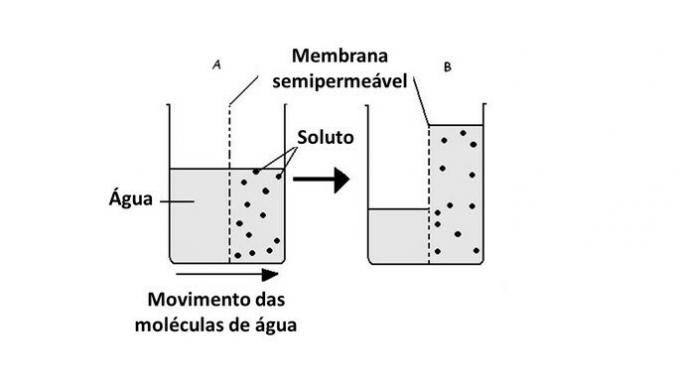
Veden kulkeutuminen väliaineesta toiseen tapahtuu soluissa proteiinien kuljettamisen avulla kalvossa, akvaporiinissa. Siksi osmoosia esiintyy aina, kun solun ulkoisen ja sisäisen ympäristön välillä on eroja konsentraatiossa.
Osmoosin tulosta käytetään eläin- ja kasvisolujen ravinteiden vaihtoprosesseissa.
Lue myös Passiivinen kuljetus ja Aktiivinen liikenne.
Hypotoninen, isotoninen ja hypertoninen liuos
Kuten olemme nähneet, osmoosiprosessin tavoitteena on tasoittaa liuosten pitoisuudet, kunnes saavutetaan tasapaino. Tätä varten meillä on seuraavan tyyppisiä ratkaisuja:
- hypertoninen ratkaisu: antaa korkeamman osmoottisen paineen ja liuenneen aineen pitoisuuden.
- hypotoninen liuos: alempi osmoottinen paine ja liuenneen aineen pitoisuus.
- isotoninen liuos: liuenneen aineen pitoisuus ja osmoottinen paine ovat samat ja saavuttavat siten tasapainon.
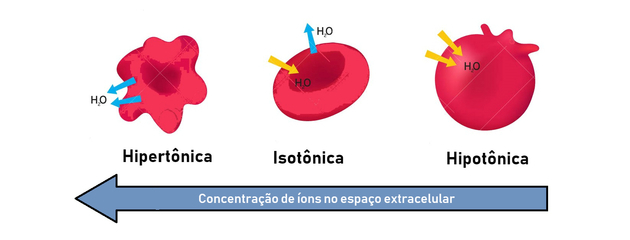
Siksi osmoosia esiintyy hypertonisen (keskittyvämmän) ja hypotonisen (vähemmän keskittyvän) tavan välillä tuottaa tasapaino.
esimerkkejä osmoosista
Soluissa plasmamembraani on lipidikaksoiskerroksen muodostama vaippa, joka estää veden liikkumisen solussa. Sen rakenteeseen on kuitenkin erikoistunut proteiineja, akvaporiineja, jotka toimivat kanavina, jotka helpottavat vesimolekyylien kulkemista.
Hypertonisessa ympäristössä solut pyrkivät kutistumaan, kun ne menettävät vettä. Hypotoniseen väliaineeseen sijoitettu solu voi turvota, kunnes se rikkoutuu, kun soluun tapahtuu vettä.
Katso alla, kuinka osmoosi esiintyy eläin- ja kasvisoluissa.
Osmoosi eläinsoluissa
kun eläinsolu, kuten punasolut, altistetaan väliaineille, joiden pitoisuus on erilainen, veden liike solussa tapahtuu seuraavasti:
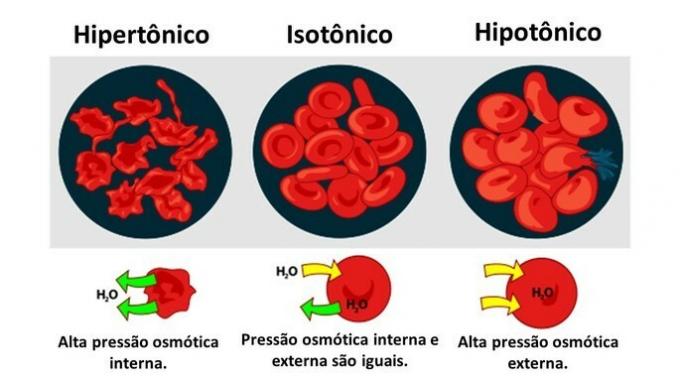
Kun väliaineessa on runsaasti liuenneita aineita, liuos, joka on hypertoninen sytoplasmaan nähden, solut menettävät vettä väliaineeseen ja kuihtuvat.
Kun väliaine on huono liuenneessa aineessa, hypotonisessa liuoksessa, vesimolekyylit pyrkivät pääsemään soluun, ja vaikka kalvo on kestävä, määrästä riippuen häiriöitä voi esiintyä.
Kasvisolujen osmoosi
Veden liike kasvisoluissa tapahtuu solun vakuolin ja solunulkoisen ympäristön välillä.
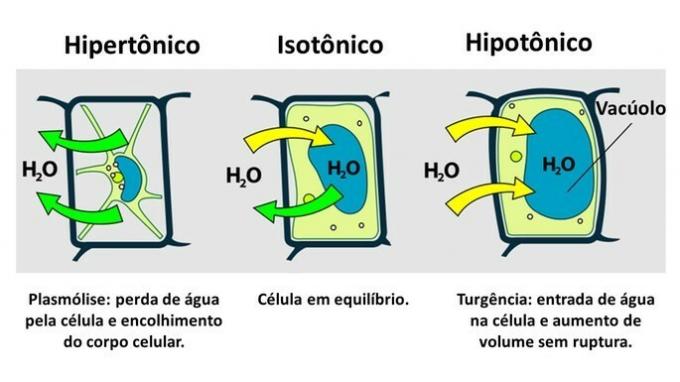
THE kasvisolu sillä on plasmakalvon lisäksi erittäin kestävä soluseinä, joka muodostuu selluloosasta.
Siksi, toisin kuin eläinsolu, kasvisolu vastustaa häiriöitä, kun se viedään hypotoniseen ympäristöön, jossa vesi pyrkii pääsemään soluun. Solu turpoaa ja lisää tilavuuttaan, mutta soluseinä estää repeämisen.
Hypertoniseen ympäristöön insertoidun kasvisolun aiheuttamaa veden menetystä kutsutaan plasmolyysiksi. Veden tuloa vakuoliin, kun solu on hypotonisessa väliaineessa, kutsutaan turgenssiksi, kun solutilavuus lisääntyy.
Kuinka osmoottinen paine vaikuttaa osmoosiin?
Liuotettu aine on mikä tahansa aine, joka voidaan laimentaa liuottimeen, kuten veteen liuotettu sokeri. Vaikka osmoottinen paine on veden liikkumiseen kohdistuva paine.
Koska osmoosi on prosessi, joka tapahtuu vähiten konsentroidusta (hypotonisesta) väkevöityimpään (hypertoniseen) väliaineeseen tasapainon etsiminen, osmoottinen paine on järjestelmään kohdistuva paine estämään osmoosin syntymistä luonnollisesti.
Siksi mitä suurempi pitoisuusero hypertonisen ja hypotonisen väliaineen välillä on, sitä suurempi on osmoottinen paine, joka kohdistetaan väkevämpään liuokseen osmoosin välttämiseksi.
Lisätietoja osmoottinen paine.
Mikä on käänteisosmoosi ja miten se toimii
Käänteisosmoosi on veden kulkeutuminen vastakkaiseen suuntaan kuin osmoosi. Siten vesi siirtyy väkevämmästä liuoksesta vähemmän väkevään.
Käänteisosmoosi tapahtuu soveltamalla luonnollista osmoottista painetta suurempaa painetta.
Koska puoliläpäisevä kalvo sallii vain liuottimen (puhtaan veden) kulkemisen, se pidättää liuenneita aineita.
Esimerkki käänteisosmoosista on suolaveden muuntaminen makeaksi suolanpoistoprosessin avulla.
Lisätietoja käänteinen osmoosi.
Ero osmoosin ja diffuusion välillä
Diffuusio on vedessä liuenneiden hyvin pienten kaasumolekyylien ja liuenneiden aineiden kulkeutuminen plasmakalvo. Tässä tapauksessa liuenneet molekyylit siirtyvät väkevämmästä väliaineesta vähemmän väkevöityyn väliaineeseen. Ne liikkuvat pitoisuusgradienttia pitkin ja levittyvät käytettävissä olevaan tilaan.
THE helpottanut diffuusiota se on sellaisten aineiden kulkeutuminen kalvon läpi, jotka eivät liukene lipideihin, proteiinien avulla, jotka läpäisevät lipidikaksoiskerroksen.
Kuten osmoosin, diffuusiota pidetään myös a passiivinen kuljetus, koska se tapahtuu pitoisuusgradientin hyväksi.
Uteliaisuus
Ilmaisua "oppiminen osmoosilla" käyttävät laajalti opiskelijat, jotka haluavat oppia uutta sisältöä tarvitsematta opiskella, eli vaivattomasti.
Lue myös:
- Liuotettu aine ja liuotin
- Natrium- ja kaliumpumppu
- Selektiivinen läpäisevyys


