THE osmoottinen paine se on kolligatiivinen ominaisuus, joka vastaa järjestelmään kohdistuvaa painetta osmoosin spontaanin esiintymisen estämiseksi.
Osmoosi on veden kulku vähemmän väkevästä (hypotonisesta) keskittyneemmään (hypertoniseen) väliaineeseen puoliläpäisevän kalvon läpi, kunnes tasapaino saavutetaan.
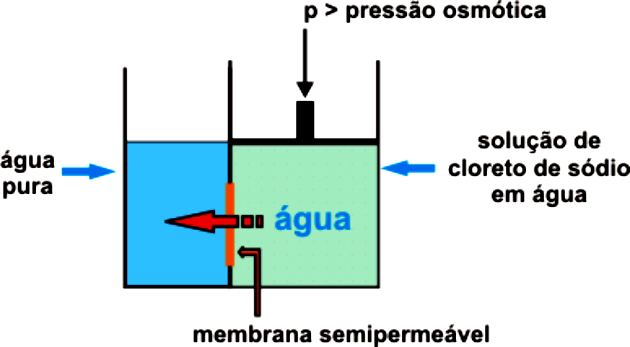
Osmoosin alkamisen ja luonnollisen tapahtumisen estämiseksi on välttämätöntä käyttää ulkoista painetta väkevämpään liuokseen estämällä liuottimen kulkeutuminen väkevämpään väliaineeseen. Se on osmoottinen paine.
Mitä väkevämpi liuos on, sitä suurempi osmoottisen paineen tulisi olla. Siksi osmoottinen paine on verrannollinen liuenneen aineen pitoisuuteen.
Kuinka lasketaan osmoottinen paine?
Jokaisella liuoksella on erilainen osmoottisen paineen arvo. Osmoottinen paine voidaan laskea seuraavasta kaavasta:
π = M. A. T. i
Missä meillä on seuraavat muuttujat:
π = osmoottinen paine;
M = konsentraatio mol / l;
R = yleinen kaasuvakio, jonka arvo vastaa 0,082 atm. L. mol-1. K-1 tai 62,3 mm Hg L. mol-1. K-1;
T = lämpötila absoluuttisella asteikolla (Kelvin);
i = Van’t Hoff -kerroin, joka käsittää lopullisten ja alkupartikkeleiden kokonaismäärän suhteen ioniliuoksissa.
Harjoitus ratkaistu
1. (Puccamp-SP) Joskus 0,30 M glukoosiliuosta käytetään laskimoon annettavana injektiona, koska sen osmoottinen paine on lähellä veren painetta. Mikä on mainitun liuoksen osmoottinen paine ilmakehissä 37 ° C: ssa?
a) 1,00.
b) 1,50.
c) 1,76.
d) 7,63.
e) 9,83.
Ottaen huomioon kysymyksen tarjoamat tiedot, meillä on:
M = 0,30 mol / L;
R = 0,082 atm. L. mol-1. K-1
T = 37 ° + 273 = 310 K.
Sinun on nyt sovellettava näitä arvoja kaavaan osmoottisen paineen laskemiseksi:
π = M. A. T. i
π = 0,30. 0,082. 310
π = 7,63 atm (Vaihtoehtoinen)
Ratkaisujen luokitus
Liuokset voidaan luokitella kolmeen osmoottisen paineen mukaan:
- hypertoninen ratkaisu: Korkeampi osmoottinen paine ja liuenneiden aineiden pitoisuus.
- isotoninen liuos: Kun liuoksilla on sama osmoottinen paine.
- hypotoninen liuos: Alhaisempi osmoottinen paine ja liuenneiden aineiden pitoisuus.

Osmoottisen paineen merkitys eläville olennoille
Suolaliuos on aine, joka on valmistettu osmoottisen paineen periaatteiden perusteella. Sitä tulee käyttää osmoottisessa paineessa, joka on yhtä suuri kuin kehossa, tämä estää Punaiset solut älä kärsi hemolyysistä tai kutistu.
Veren osmoottinen paine on noin 7,8 atm. Siksi organismin moitteettoman toiminnan kannalta punasoluilla on oltava sama osmoottinen paine, mikä varmistaa normaalin veden virtauksen soluihin ja ulos soluista.
Esimerkiksi dehydraatiossa on ilmoitettu suolaliuoksen käyttö, jonka on oltava isotoninen verisoluihin ja muihin kehon nesteisiin nähden.
Suolaliuoksen tehtävänä on palauttaa osmoottinen tasapaino kehon sisällä. Tämä johtuu siitä, että dehydraation aikana veri keskittyy enemmän kuin solujen sisäpuoli, jolloin ne kuihtuvat.
Osmoosi ja käänteisosmoosi
Kuten olemme nähneet, osmoosi se on prosessi, jossa vesi siirretään hypotonisesta ympäristöön hypertoniseen ympäristöön puoliläpäisevän kalvon läpi, kunnes pitoisuuksien välinen tasapaino saavutetaan.
Samaan aikaan käänteinen osmoosi se on prosessi aineiden erottamiseksi kalvon läpi, joka pitää liuenneen aineen. Liuotin virtaa väkevämmästä väliaineesta vähemmän väkevään ja eristetään liuenneesta aineesta kalvolla, joka sallii sen kulkemisen.
Tämä tapahtuu vain johtuen kohdistetusta paineesta, jolloin puoliläpäisevä kalvo sallii vain veden kulkemisen säilyttäen liuenneen aineen. Tämän paineen on oltava suurempi kuin luonnollinen osmoottinen paine.
Esimerkiksi, jos käytetty osmoottinen paine on suurempi kuin tarpeen, tapahtuu käänteisosmoosi. Siten virtaus kulkee väliaineesta, jolla on korkein pitoisuus, pienimpään.