Kun kaksi ratkaisua sekoitetaan riippumatta siitä, ovatko ne erilaisia vai ei, on ensin analysoitava, onko niiden välillä reaktio vai ei. Jos esimerkiksi sekoitetaan vesiliuos sokerin (sakkaroosin vesiliuos) kanssa suolaliuoksen (suolaliuos) kanssa, saadaan liuosten sekoittaminen ilman kemiallisia reaktioita.
Sama tapahtuu, jos sekoitetaan kaksi natriumkloridiliuosta (NaCl), eri pitoisuuksilla. Tässä tapauksessa ei myöskään tule mitään reaktiota. Voimme sitten määritellä tämän esimerkin a: ksi saman liuenneen aineen liuosten sekoittaminen ilman kemiallisia reaktioita, jossa ensimmäinen esimerkki on a eri liuenneiden aineiden liuosten sekoittaminen ilman kemiallista reaktiota.
Molemmissa tapauksissa liuosten komponenttien kemiallinen koostumus ei muutu.Jotkin määrälliset näkökohdat on kuitenkin laskettava uudelleen.
Jotta ymmärtäisimme, kuinka voimme määrittää moolipitoisuuden (molaarisuuden) ja liuosten seoksen yhteisen pitoisuuden ilman reaktiota, katsotaanpa mainittujen kahden tapauksen ratkaisu:
1) Saman liuenneen aineen seos ilman kemiallista reaktiota:

Kuvittele, että sekoitamme kaksi natriumkloridiliuosta, toisen, jonka pitoisuus on 2,0 g / l 60,0 ml: ssa liuosta, ja toisen 2,5 g / l: n kanssa 80 ml: ssa liuostilavuutta.
Koska reaktiota ei tapahdu, sekä massa että tilavuus ovat vain alkumassojen ja tilavuuksien summa:
m (liuos) = m1 (NaCl) + m2 (NaCl)
m1 (NaCl) = v. C m2 (NaCl) = v. Ç
m1 (NaCl) = 0,06 1. 2,0 g / l m2 (NaCl) = 0,08 1. 2,5 g / l
m1 (NaCl) = 0,1 g2 (NaCl) = 0,2 g
m (liuos) = 0,1 g + 0,2 g
m (liuos) = 0,3 g
v (liuos) = v1 (NaCl) + v2 (NaCl)
v (liuos) = (60 + 80) ml
v (liuos) = 140 ml = 0,14 L
Pitoisuus voidaan sitten saada käyttämällä näitä tietoja:
C (liuos) = m (liuos)
v (ratkaisu)
C (liuos) = 0,3 g
0,14 litraa
C (liuos)≈ 2,14 g / l
2.) Eri liuenneiden aineiden seos ilman kemiallista reaktiota:
Otetaan esimerkiksi seos, joka on 500 ml sakkaroosin vesiliuosta (C12H22O11), jonka pitoisuus oli alun perin 18,0 g / l, 1 l: lla suolavettä (natriumkloridin vesiliuos - NaCl), jonka pitoisuus oli 100,0 g / l.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Mistä sekoituksen jälkeen tuli seoksen tuloksena olevan liuoksen molaarisuus, yleinen pitoisuus, massa ja tilavuus?
Koska kemiallista reaktiota ei tapahtunut, C: n massat12H22O11 ja NaCl pysyvät muuttumattomina. Ja alkuperäiset massa-arvot voidaan saavuttaa yksinkertaisella kolmella säännöllä käyttäen reaktiopitoisuuksia.
18,0 g 1 litra
m (C12H22O11) 0,5 L
m (C12H22O11) = 9,0 g
m (NaCl) 100,0 g
Massa voidaan saavuttaa myös kaavalla:
m = v. Ç
m (C12H22O11) = 0,5 litraa 18g / l
m (C12H22O11) = 9,0 g
m (NaCl) = 1 L. 100,0 g / l
m (NaCl) = 100,0 g
Täten liuoksen kokonaismassa on kahden massan summa:
m (liuos) = m (C12H22O11) + m (NaCl)
m (liuos) = 109,0 g
Tilavuus on yksinkertaisesti alkuperäisten määrien summa, joten meillä on:
v (lopullinen liuos) = v (C12H22O11) + v (NaCl)
v (lopullinen liuos) = (0,5 + 1) L
v (lopullinen liuos) = 1,5 l
Lopullinen pitoisuus saavutetaan laskemalla erikseen kunkin liuenneen aineen pitoisuudet. Koska ne eivät reagoi keskenään ja niiden massat eivät muutu, voimme käyttää seuraavaa pitoisuuskaavaa:
C = m
v
alkukirjain = malkukirjain lopullinen c = mLopullinen
valkukirjain vLopullinen
malkukirjain = mLopullinen
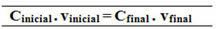
C (C12H22O11) =?
Çalkukirjain. valkukirjain = CLopullinen. vLopullinen
18,0 g / l. 0,5 l = CLopullinen .1,5 l
C (C12H22O11) Lopullinen = 6,0 g / l
C (NaCl) =?
Çalkukirjain. valkukirjain = CLopullinen. vLopullinen
100,0 g / l. 1 L = lopullinen. 1,5 L
C (NaCl)Lopullinen = 66,67 g / l
Tämän yhteisen pitoisuuden tämän kaavan mukainen suhde voidaan tehdä myös laskemaan molaarisuus (Mi. vi = Mf. vf) ja massapitoisuuden suhteen massana (osasto - Ti. vi = Tf. vf).
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta



