THE entalpia (H) se voidaan määritellä kunkin materiaalin energiasisällöksi tai järjestelmän kokonaisenergiaksi. Käytännössä ei kuitenkaan ole mahdollista määrittää aineen entalpiaa. Joten mitataan yleensä entalpian vaihtelu 

Analysoimme tässä entalpian vaihtelua eksotermisissä reaktioissa (sana "exo" tulee kreikan kielestä ja tarkoittaa "ulos, ulos, ulos"), jotka ovat reaktioita, joissa vapautuu lämpöä. Jokapäiväisessä elämässä on monia esimerkkejä näistä reaktioista, kuten palaminen ja sammutetun kalkin ja veden seos.
Näissä tapauksissa entalpian vaihtelu 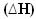 on täsmälleen vapautuneen lämmön määrä, joka saadaan lopullisen entalpian arvosta miinus alkuperäinen entalpia (Hf - Hi) tai reaktiona tuotteiden entalpiaarvo miinus reagoivien (HP - HR).
on täsmälleen vapautuneen lämmön määrä, joka saadaan lopullisen entalpian arvosta miinus alkuperäinen entalpia (Hf - Hi) tai reaktiona tuotteiden entalpiaarvo miinus reagoivien (HP - HR).
Kun lämpöä vapautuu, energia menetetään. Siten järjestelmän kokonaisenergia pienenee, joten tuotteiden entalpia on aina pienempi kuin reagenssien, joten entalpian vaihtelu eksotermisissä reaktioissa on aina negatiivinen, pienempi kuin nolla 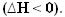
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Harkitaan yleistä eksotermistä reaktiota:
| A → B + lämpö |
Tämä voidaan ilmaista käyttämällä alla olevan kaltaista entalpiakaaviota:
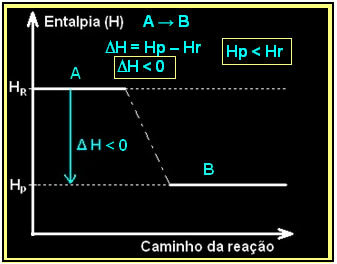
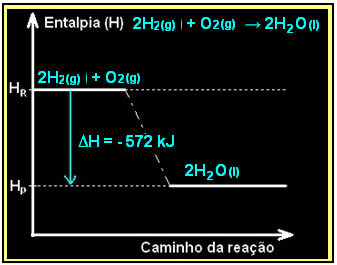
Vetykaasun palaminen ja nestemäisen veden muodostuminen tapahtuu vapauttamalla energiaa. Järjestelmän entalpian vaihtelun arvo tässä reaktiossa saadaan seuraavasti:
2h2 g) + O2 g) → 2H2O(1)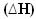 = - 572 kJ
= - 572 kJ
Kaaviosi olisi esitetty seuraavasti:
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Entalpian vaihtelu eksotermisissä reaktioissa"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/variacao-entalpia-reacoes-exotermicas.htm. Pääsy 28. kesäkuuta 2021.
Kemia

Lämpökemia, entalpia, vapautunut lämpö, eksoterminen reaktio, polttoreaktio, ulkoinen ympäristö, endoterminen reaktio, reaktio kemia, energianvaihto, reagenssit, valonsäteily, valon absorptio, lämpö, sähkö, komponentit, fyysinen tila, Tuotteet.