Linus Paulingin vuonna 1960 luoman orbitaalimallin mukaan kovalenttinen sidos, joka muodostaa - molekyylit tapahtuvat fuusioimalla tai tunkeutumalla epätäydellisten orbitaalien osaan alkuaineista Linkki. Siten päätellään, että jos elementillä on epätäydellinen kiertorata (vain yhden elektronin kanssa), se voi muodostaa vain kovalenttisen sidoksen. Jos sillä on kaksi epätäydellistä kiertorataa, se voi muodostaa enintään kaksi yhteyttä jne.
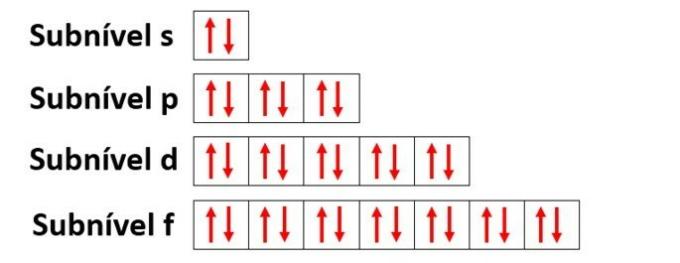
Katsokaa kuitenkin hiiliatomin alkuaineen orbitaaleja, joiden atomiluku on 6 (Z = 6):

Huomaa, että sillä on kaksi epätäydellistä kiertorataa, joten sen tulisi suorittaa vain kaksi sidontaa. Sitä ei kuitenkaan tapahdu hänelle. Kuten monet tietävät, hiili muodostaa neljä sidosta (se on neliarvoinen), joten tämä orbitaalimalli ei selitä hiilen tapausta.
Tämän umpikujan lopettamiseksi luotiin uusi teoria, joka selitti paremmin tämän asian: Hybridisaatioteoria.

Tämä tarkoittaa, että hybridisaatio on puhtaiden orbitaalien "sekoitus".
Hiilen osalta hybridisaatiota on kolme tyyppiä: sp3, sp2 ja sp.
Ymmärtääksemme kuinka hybridisaatio tapahtuu, katsotaanpa ensimmäisen tyyppinen hiilihybridisaatio, sp-tyyppi.3:
Tämän tyyppinen hybridisaatio tapahtuu metaanimolekyylissä (CH4). Huomaa, että hiilen, joka on keskeinen elementti, ja neljän vedyn välillä on neljä samanlaista kovalenttista sidosta. Joten, katso mikä epätäydellinen vety-kiertorata on:
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)

Koska jokaisella vedyllä on epätäydellinen s-tyyppinen kiertorata, on välttämätöntä saada yksi elektroni lisää, toisin sanoen kukin niistä muodostaa vain yhden kovalenttisen sidoksen hiilen kanssa. Siksi hiilellä on oltava neljä epätäydellistä kiertorataa. Kuinka tämä tapahtuu? Hybridisaation kautta.
Kun elektroni 2s-kiertoradalta absorboi energiaa, se siirtyy tyhjään 2p-kiertoradalle. Siksi sanomme, että tämä elektronin hyppy 2s: stä 2p: n alatasoon on elektronin "edistäminen". Tällä tavalla hiili pysyy viritetyssä tai aktivoidussa tilassaan, ja kovalenttisten sidosten suorittamiseen on käytettävissä neljä hybridisoitunutta orbitaalia:

Huomaa, että muodostuneet hybridiorbitaalit vastaavat toisiaan, mutta eroavat alkuperäisistä puhtaista orbitaaleista.
Tällä tavalla sidos jokaisen neljän vetyatomin s-orbitaalin välillä tapahtuu näiden neljän hybridisoidun hiilipyörän kanssa:

Kuten edellä nähdään, metaanimolekyylillä on säännöllinen tetraedrirakenne, jossa on neljä elektronipilveä kussakin kärjessä ja vierekkäiset kulmat 109 ° 28 ’. Koska sidos muodostui jokaisen vedyn s-orbitaalin ja hybridisoidun sp-orbitaalin välille3 jokaiselle yhteydelle meillä on, että ne ovat neljä sigma s-sp -linkkiä3 (σs-sp3).
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Sp3-tyyppinen hybridisaatio"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm. Pääsy 28. kesäkuuta 2021.