Tilavuusanalyysi tai tilavuus se on a laboratoriomenettely, jossa käytämme tiettyä määrää a ratkaisu sisään pitoisuus tiedetään toisen liuoksen pitoisuuden määrittämiseksi. Tunnetun konsentraation liuoksen tilavuus määritetään, kun se reagoi täysin tuntemattoman konsentraation liuoksen kanssa, toisin sanoen kyseessä olevien liuosten on reagoitava toistensa kanssa.
Tietyn tilavuuden mittaamiseen käytetään eniten instrumentteja:
- Pipetti

Esimerkki tilavuuden mittauksessa käytetystä pipetistä
- Byretti

Byretti on tärkeä tilavuusmittauslaite
Tilavuuden mittaus tehdään arvioimalla ns. Meniskin korkeus, joka ei ole muuta kuin nesteen pinta-ala, jolla on suorakaiteen tai kupolin muoto (pisaran muoto) astian paksuudesta riippuen. Mitä laajempi astia, sitä suorakulmaisempi meniski; mitä ohuempi astia, sitä kuperampi se on. Meniskin arvioimiseksi silmän on oltava täsmälleen sen korkeudella, ja meidän on käytettävä vertailukohtana alempaa aluetta, jos meniski on suorakaiteen muotoinen, tai kärkeä, jos se on pullistunut. Katso arvioinnin esitys:
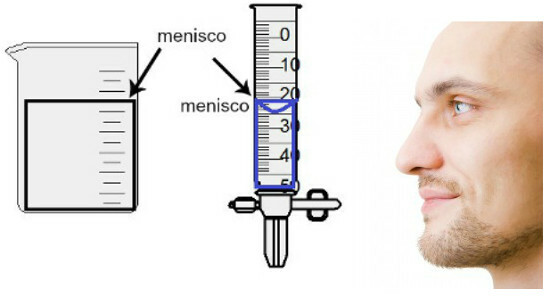
Meniskin arvioimiseksi on tärkeää, että silmäsi katsovat sitä.
Tilavuusanalyysissä eniten käytetty laite on byretti. Tämä johtuu siitä, että koska menetelmä sisältää kemiallisia reaktioita ja ne voidaan prosessoida nopeasti, byretti sallii neste vapautuu kärjestään pisaroina, mikä antaa meille mahdollisuuden estää nestettä tulemasta ulos enemmän hallittu.
Yksi käytetyimmistä menetelmistä tilavuudessa on titraus. Se on tilavuusanalyysi, johon liittyy hapon ja emäksen välinen reaktio tai päinvastoin. Sen toteuttamiseen tarvittavat laitteet on esitetty alla olevassa kuvassa:
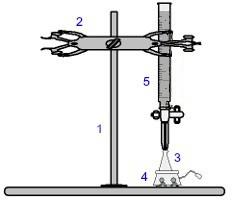
Esitys titrauksessa käytetyistä laitteista
Sinisen numerot tarkoittavat:
1) Universaali tuki;
2) Kynsi (käytetään byretin pitämiseen);
3) Erlenmeyer (saa liuoksen, jonka pitoisuus on tuntematon);
4) Magneettisekoitin (käytetään Erlenmeyer-pullossa olevan liuoksen sekoittamiseen);
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
5) Byretti (vastaanottaa tunnetun konsentraation liuosta).
Erlenmeyerpulloon lisätään tilavuus liuosta, jonka konsentraatio on tuntematon fenolftaleiini-indikaattorilla (liuos muuttuu välittömästi vaaleanpunaiseksi). Byretissä asetetaan tietty määrä tunnetun konsentraation liuosta. Sitten byretin happoliuos tiputetaan suoraan emäksiseen liuokseen Erlenmeyer-pullossa. Tämä tippuminen kestää, kunnes emäsliuos muuttuu värittömäksi, jolloin me kutsumme käännekohtaa, mikä osoittaa, että kaikki liuoksessa oleva emäs on täysin reagoinut hapon kanssa.
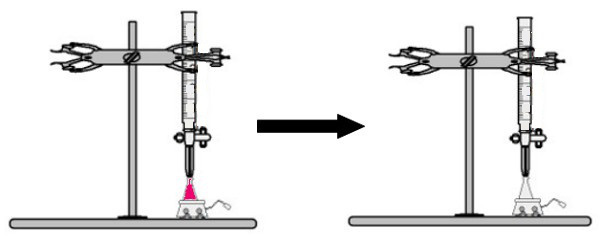
Käännekohdassa liuos ei ole enää vaaleanpunainen ja muuttuu värittömäksi
Havainto: Jos liuos, jonka konsentraatiota ei tunneta, on happoa, kun se saa fenolftaleiini-indikaattorin, se on väritön. Siten titrauksen käännekohta on, kun hapan liuos muuttuu vaaleanpunaiseksi, kun se saa emäksisen liuoksen byretistä.
Lopuksi määritä emäksisen liuoksen pitoisuus vain seuraavalla yhtälöllä:
Ma.Va = Mb.Vb
Ma = hapon molaarisuus;
Va = happotilavuus;
Mb = perusmolaarisuus;
Vb = perusmäärä.
Seuraa nyt esimerkkiä siitä, miten lasketaan ratkaisu, jonka molaarisuus on tuntematon.
1.) 30 ml tuntematonta emäsliuosta lisättiin Erlenmeyer-pulloon titrauksen suorittamiseksi sen pitoisuuden (molaarisuuden) määrittämiseksi. Byrettiin lisättiin 50 ml happoliuosta, jonka konsentraatio oli 0,2 mol / l. Happoliuoksen pudottamisen jälkeen ja kunnes emäksinen liuos oli titrattu, havaittiin, että titrauksessa käytettiin 20 ml happoliuosta. Määritä käytetyn emäsliuoksen molaarisuus.
Harjoitustiedot:
Vb = 30 ml
Mb =?
Ma = 0,2 mol / l
Va = 20 ml
Koska hapon molaarisuus ja sen tilavuus ovat vastaavasti 0,2 mol / l ja 20 ml ja käytetyn emäksen tilavuus on 30 ml, käytä vain titrauskaavaa:
Ma.Va = Mb.Vb
0,2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol / l
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Volometrinen analyysi tai volumetria"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm. Pääsy 28. kesäkuuta 2021.
