Metallit ovat elementtejä, joille on tunnusomaista kirkkaus, lujuus, lämpö- ja sähkönjohtavuus. He ovat sovellettavissa käytännössä kaikkiin teollisiin prosesseihin, olla läsnä metalliseoksissa, joita käytetään työkalujen, korujen ja kolikoiden valmistuksessa, ja kemiallisissa prosesseissa, kuten pinoja ja paristot.
Jaksollisessa taulukossa ne on luokiteltu:
semimetals
siirtymämetallit
alkalimetallit
maa-alkalimetallit
Terästeollisuudessa ne on jaoteltu:
rautametallit
rautaa sisältämättömät metallit
raskasmetallit
Lue myös: Mitkä ovat jaksollisen taulukon uudet elementit?
Metalliominaisuudet

Ne ovat pääosin erinomaisia lämmön ja sähkön johtimia.
Niillä on kiiltävä ulkonäkö.
on korkea tiheys.
Ne ovat elektropositiivisia elementtejä (niillä on taipumus muodostaa kationeja - positiivisia varauksia).
Lukuun ottamatta Elohopea, ne ovat alkuaineita, joilla on korkea sulamispiste ja kiinteitä huoneenlämpötilassa.
Niillä on mekaaninen lujuus (sitkeys).
Ne ovat muokattavia (voidaan valaa rikkomatta).
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Jaksolliset taulukot
alkalimetallit
Ovatko jaksollisen järjestelmän ensimmäinen sarake, perhe 1A. Niitä kutsutaan alkalimetalleiksi, koska sekoitettuina veteen ne muodostavat hydroksideja eli emäksisen (emäksisen) liuoksen.
Sinä elementtejä Tähän ryhmään kuuluvat:
Litium (li)
Natrium (At)
Kalium (K)
Rubidium (Rb)
Cesium (Cs)
Francium (Fr)
Alkalimetallien elektroninen konfiguraatio neutraalissa tilassa (varaamaton / ionisoitumaton) on vain elektroni viimeisessä kuoressa (valenssikerros). O atomisäde ja näiden metallien reaktiivisuus kasvaa ylhäältä alas (tarkkailemalla Jaksollinen järjestelmä). Niiden sulamispiste on alhainen muihin metalleihin nähden, ne ovat tempervaluneita ja eivät kovin tiheitä, niillä on matta korkea hapettumispotentiaali.
Katso myös:Mitkä ovat aineen ominaisuudet?
maa-alkalimetallit
Nämä ovat elementtejä, jotka näkyvät jaksollisen järjestelmän toinen sarake, perhe 2A. kutsutaan emäksinen maa taipumuksella muodostaa emäksisiä (emäksisiä) ja maanläheisiä liuoksia, koska näiden aineiden muodostamat oksidit nimettiin tällä tavalla ennen 1800-lukua. Tätä termiä käytettiin kuvaamaan liukenemattomia ei-metalleja, joille ei tapahtunut mutaatiota kuumennettaessa, ryhmän 2 alkuaineiden yhteisiä ominaisuuksia. Myöhemmin uusien tutkimusten ja kokeiden valossa havaittiin, että "maa" -elementit olivat itse asiassa metallien muodostamia oksideja.
Ne ovat muovattavia metalleja, joilla on pieni tiheys kaksi elektronia uloimmassa kuoressaan, todetaan normaaleissa lämpötilan ja paineen olosuhteissa kiinteässä tilassa. Kuuluu tähän ryhmään:
Beryllium (Olla)
Magnesium (Mg)
Kalsium (Tässä)
Strontium (herra)
Barium (Ba)
Radio (Sammakko)
siirtymämetallit
muodostavat jaksollisen taulukon ryhmä B, ja sijaitsevat maa-alkalimetallien ja ametals. IUPAC määritteli ne elementeiksi, joilla on epätäydellinen energéticadin energinen alikerros. Termi "siirtymämetallit" viittaa siirtyminen ryhmästä 2 ryhmään 13 ja elektronien lisääntyvä kasvu d-kiertoradalla.
Siirtymämetalliryhmä koostuu tiheistä elementeistä, joilla on korkeat sulamis - ja kiehumispisteet, ja vähemmän reaktiivinen kuin ryhmän 1 ja 2 metallit (Perhe 1A ja 2A). Siirtymämetallien joukossa ovat volframi, jolla on korkein sulamispiste (3422 ° C), ja elohopea (Hg), joka on metalli, joka on nestemäistä normaaleissa lämpötilan ja paineen olosuhteissa, sen sulamispiste on (-38,83 ° C).
Siirtymämetalleilla on erilaisia hapetustiloja (NOX vaihteleva) ja muodostavat värillisiä aineita.

Sisäiset siirtymäelementit
Sisäiset siirtymäelementit he ovat:
Lantanidit: sarja, joka koostuu elementeistä, joissa on 57 - 71 protonia ja jotka ovat prometiumia lukuun ottamatta luonnollisia.
Aktinidit: ryhmä, jonka muodostavat alkuaineet, joiden atomiluku on 89-103 ja jotka ovat suurimmaksi osaksi synteettisiä. Kaikki tämä ryhmä ovat radioaktiivinen lyhyt puoliintumisaika.
Näiden kahden ryhmän alkuaineilla on korkea sulamispiste ja ne kaikki ovat kiinteitä huoneenlämpötilassa.
Puolimetallit
Sinä semimetals on kaikkiaan seitsemän elementtiä:
Boori (B)
Pii (Si)
Germaanium (ge)
Arseeni (As)
Antimoni (Ma)
Telluurium (Te)
Polonium (Po)
Tämä luokitus annetaan elementeille, joilla on fysikaalis-kemialliset ominaisuudet, jotka koskevat metalleja ja myös muita, jotka koskevat muita kuin metallisia alkuaineita. Semimetalleilla on kiilto, ne ovat hauraita yhdisteitä, kykenevät muodostamaan kationeja ja myös anioneja (olosuhteista riippuen) ja ovat välijohtimia.
Metallien tyypit
Rauta: aineet, jotka sisältävät rautaa koostumuksessaan. He ovat metalliseokset jotka sisältävät rautaa yleisenä alkuaineena, mutta ne voidaan formuloida eri pitoisuuksilla hiiltä, esimerkiksi tai taottu eri tekniikoilla, jolloin tuotteilla on erilaiset fysikaaliset ominaisuudet.
Ei-rautametalli: seokset, jotka on muodostettu muun tyyppisistä metalleista, kuten alumiini, kupari-, nikkeli, sinkki, titaani.
Raskasmetallit: lyijy, nikkeli, sinkki, elohopea. Ne ovat reaktiivisia, myrkyllisiä ja biokertyviä metalleja. Niitä käytetään muun muassa paristoissa, lampuissa, sotatarvikkeiden ammuksissa.
Metallien kemialliset sidokset
Metallit ovat elementtejä sähköpositiivineneli heillä on taipumus menettää elektroneja kemiallisessa sidoksessa. Kun metalli on vuorovaikutuksessa ei-metallin kanssa, se suorittaa ionisidoksen eron vuoksi elektronegatiivisuus. Toinen metallien sitoutumismahdollisuus on metallisidokset.
Klo metalliliitännät metallien välillä, elektronien osittaisen vapautumisen myötä ja elektronien pilven tai meren muodostumisen atomien ympärille, mikä takaa metalliosille johtavuus sähköinen ja muovattavuus.
Katso myös: Johtimet ja eristeet - mitkä ovat erot?
Metallien hankinta
Suurin osa metalleista löytyy luonnostaan kiviainekset ja mineraalit, jotka liittyvät muihin alkuaineisiin. Metallien puhdistamiseksi on useita tekniikoita, kuten elektrolyysillä ja kemiallisilla reaktioilla erillisten yhdisteiden muodostamiseksi.
Metallien tapauksessa kaksi teollisessa mittakaavassa eniten käytettyä tekniikkaa tietyn puhtausasteen saavuttamiseksi metallissa ovat: ero tiheys ja magneettinen herkkyys (taipumus, että metallin on reagoitava a magneettikenttä).

ratkaistut harjoitukset
Kysymys 1 - (Enem) Paristoissa oleva kadmium voi päästä maahan, kun näitä materiaaleja hävitetään epäsäännöllisesti ympäristössä tai kun ne poltetaan. Toisin kuin metallimuodossa, Cd2 + -ionit ovat erittäin vaarallisia keholle, koska ne voivat korvata Ca2 + -ionit aiheuttavat rappeuttavan sairauden luissa, mikä tekee niistä hyvin huokoisia ja aiheuttaa voimakasta kipua luissa. nivelet. Ne voivat myös estää Zn2 + -kationin aktivoimia entsyymejä, jotka ovat erittäin tärkeitä munuaisten toiminnalle. Kuvassa on esitetty joidenkin metallien ja niiden kationien säteen vaihtelu.
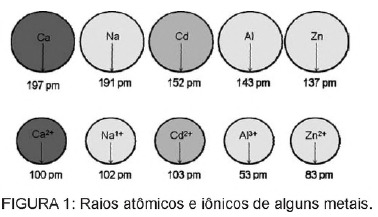
Tekstin perusteella kadmiumin myrkyllisyys ionimuodossaan on seurausta tästä tekijästä
A) läsnä on pieni ionisaatioenergia, joka suosii ionin muodostumista ja helpottaa sen sitoutumista muihin yhdisteisiin.
B) niillä on taipumus toimia biologisissa prosesseissa, joita välittävät metallikationit varauksilla välillä +1 - +3.
C) niiden säde ja varaus ovat suhteellisen lähellä biologisiin prosesseihin vaikuttavia metalli-ioneja aiheuttaen häiriöitä näihin prosesseihin.
D) niillä on suuri ionisäde, jolloin se voi puuttua biologisiin prosesseihin, joihin normaalisti osallistuvat pienemmät ionit.
E) on +2-varaus, mikä sallii sen häiritä biologisia prosesseja, joihin normaalisti osallistuvat pienempiä varauksia sisältävät ionit.
Resoluutio
Vaihtoehto C. Kadmium on elementti, joka on samanlainen kuin metalliset ionit, joita meillä luonnollisesti on kehossa. Biokertyvyyden lisäksi kadmium, jolla on tämä samankaltaisuus metalliryhmien kanssa, voi sitoutua sulfhydryyliryhmiin proteiinia, mikä aiheuttaa muutoksia biologisissa prosesseissa, kuten kalkinpoistossa, sekä kudosten ja punasolujen tuhoutumisessa verta.
Kysymys 2 - Valitse metalleille merkitykselliset ominaisuudet valitsemalla väärä vaihtoehto.
A) Useimmat metallit ovat hyviä sähkö- ja lämpöjohtimia.
B) Jotkut metallit ovat alttiita hapettumiselle ja / tai pelkistymiselle.
C) Rauta on kestävä ja muokattava metalli, eli se on helppo muovata.
D) alkalimetallimetalleilla on tämä nimi "maa", mikä viittaa näiden metallien oksideihin, joiden väri on tumma.
E) Metallit ovat erivärisiä ja himmeitä elementtejä hapettumisen vaikutuksesta.
Resoluutio
Vaihtoehto E. Metallien väri on luonnostaan kiiltävä ja metallinen, ne voivat hapettua, mikä aiheuttaa muutoksia metallin merkityksellisissä ominaisuuksissa osa, mutta tämä ei ole ilmiö, joka tapahtuu kaikissa metalleissa, ja joissakin tapauksissa hapettuminen riippuu useista tekijöistä ulkoinen.
kirjoittanut Laysa Bernardes
Kemian opettaja