Kun puhumme pH, viitataan liuoksen hydrauspotentiaaliin, toisin sanoen hydroniumkationien määrään (H+ tai H3O+), jotka dispergoidaan liuoksen liuottimeen.
Hydroniumkationit ovat hyvin tiedemiehen ehdottaman määritelmän takia Arhenius hapolle. Tämä tiedemies väittää sen happo on jokainen aine kykenevä ionisoida ja tuottaa hydrroniumioneja vesipitoisessa väliaineessa.
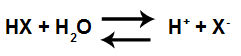
Happoionisaatioyhtälö
lyhenne pH toimii vertailuna väliaineen happamustason määrittämisessä. Mutta pitkään, kemistit ovat myös käyttäneet pH vertailuna happamuuden lisäksi sen määrittämiseksi, onko väliaine emäksinen vai neutraali.
Tämä on mahdollista, koska kemistit ovat nyt tietoisia siitä, että vesi itsensä ionisoituu, eli se tuottaa hydroniumeja (H+) ja hydroksidit (OH-). Siten vesiliuoksessa ei koskaan ole vain hydroniumia tai hydroksidia, mutta molemmat, kuten voimme nähdä seuraavasta yhtälöstä:

Veden autoionisaatioyhtälö
PH: n viitearvona käytetyt arvot
Arvot, joita käytetään pH viittaa veden ionisaatiovakioon (Kw) lämpötilassa 25 ° C
OC, joka on yhtä suuri kuin 10-14. Tässä lämpötilassa veden tuottamat hydrronium- ja hydroksidi-ionien pitoisuudet ovat ehdottomasti samat, toisin sanoen 10-7 mol / l.[H+] = [OH-]= 10-7
Tästä viitteestä käytettävät pH-arvot vaihtelevat välillä 0-14.
Kaavat pH: n laskemiseksi
a) Laskeminen hydroniumkationien pitoisuudesta mol / l
PH-arvo voidaan laskea suoraan, kunhan tiedämme hydroniumien pitoisuuden ([H+]). Katso:
pH = -log [H+]
tai
10-H = [H+]
b) Laskeminen hydroksidianionien (OH-)
pOH = -log [OH-]
tai
10-OH = [OH-]
Kun olet laskenut pOH-arvon, sinun on käytettävä sitä seuraavassa lausekkeessa pH-arvon määrittämiseksi.
pH + pOH = 14
PH-arvojen tulkinta
PH-arvon tiedossa voimme määrittää, onko kyseisellä liuoksella happama, emäksinen vai neutraali luonne. Käytä tähän vain seuraavaa kaaviollista suhdetta:
Jos pH-arvo on alle 7 = hapan väliaine;
PH: lle, jonka arvo on 7 = neutraali väliaine;
Jos pH-arvo on yli 7 = emäksinen väliaine.
Esimerkkejä
1. esimerkki: Tietäen, että hydroniumkationien pitoisuus liuoksessa on 2,10-4 mol / l, mikä pitäisi olla tämän liuoksen pH-arvo?
Liuoksen pH-arvon määrittäminen hydroniumien (H+), 2.10-4 mol / L, meidän on käytettävä seuraavaa lauseketta:
pH = -log [H+]
pH = -log [2,10-4 ]
pH = - (log 2 + log 10-4)
pH = -log2 - log10-4
pH = –log 2 - 4. log 10
pH = –0,3 + 4. (1)
pH = -0,3 + 4
pH = 3,7
2. esimerkki: Tietyn liuenneen aineen muodostaman liuoksen hydroksidi-ionipitoisuus on 10-11 mol / l. Tästä pitoisuudesta voimme sanoa, että tämän liuoksen pH on arvoinen kuinka paljon?
Liuoksen pH-arvon määrittämiseksi hydroksidipitoisuudesta 10-11 mol / L, meidän on tehtävä seuraava:
1O Vaihe: Laske pOH-arvo.
10-OH = [OH-]
10-OH = 10-11
Lauseke on kerrottava -1: llä, koska pOH on aina positiivinen tuntematon.
-OH = -11. (- 1)
pOH = 11
2O Vaihe: Laske pH-arvo.
pH + pOH = 14
pH + 11 = 14
pH = 14 - 11
pH = 3
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ph.htm


