Kun altistamme liekin toiminnalle erilaisia elementtejä, huomaamme, että kukin niistä antaa eri värin. Esimerkiksi, jos poltamme strontiumin, natriumin ja kuparisuolan, näemme vastaavasti punaiset, voimakkaat keltaiset ja vihreät värit seuraavan kuvan osoittamalla tavalla:

Jos näiden liekkien valo putoaa prismaan, a epäjatkuva spektri, ts. vain muutama värillinen kirkas viiva havaitaan alueiden välissä ilman valoa. Jokaiselle elementille meillä on erilainen spektri.

Tämäntyyppisiä spektrejä kutsutaan päästöspektri, koska tietty elementti on antanut ne ja palvelee sen tunnistamista.
Tällaisia spektrejä on mahdollista saada korkealla sähköpurkausputkessa tuotetun valonsäteen avulla lämpötilat ja alhaiset paineet, jotka sisältävät kaasuja tietyistä alkuaineista, kuten vedystä, tai jalokaasuina karjua:

Ohittamalla tämä prisman kautta tuotettu sähkömagneettinen säteily (valo) saadaan kunkin näiden elementtien emissiospektri.
Aikaisemmin ajateltiin, että saavutettu aurinkospektri oli täysin jatkuva, mutta englantilainen tiedemies William Hyde Wollaston havaitsi, että työskenneltäessä hyvin kapean valonsäteen kanssa, jonka rako oli noin 0,01 mm, voit nähdä, että aurinkopektri sisälsi seitsemän mustaa viivaa siitä. Myöhemmin nuoret
Joseph Fraunhofer (1787-1826) havaitsi prismoja ja diffraktioristikoita käyttäen, että aurinkospektri sisältää tosiasiassa tuhansia päällekkäisiä mustia viivoja.Jonkin ajan kuluttua fyysinen Gustav Robert Kirchhoff hän huomasi, että natriumspektrillä saavutetut keltaiset täplät olivat täsmälleen samassa paikassa kuin kaksi mustaa viivaa auringon spektrissä. hän ja kemisti Robert Wilhelm Bunsen suoritti useita kokeita ja huomasi, että jos Bunsen-polttimesta tuleva valkoinen valo, kuten auringonvalo, ohittaa natriumin lähettämän keltaisen valon ja prisma ylitettiin spektrin tuottamiseksi; tuloksena olisi jatkuva aurinkospektri, sateenkaaren väreissä, mutta mustat viivat (joita Fraunhofer kutsuu D-viivoiksi) ovat samassa asemassa kuin keltaiset viivat natriumspektrissä.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
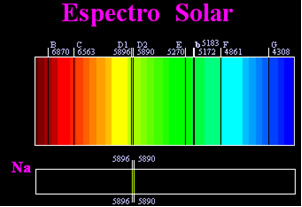
Aurinko lähettää kaiken väristä valoa punaisesta violettiin, mutta kulkiessaan maapallon ilmakehän läpi läsnä olevat kaasut absorboivat auringon valon täsmälleen niiden lähettämissä väreissä.
Tämäntyyppisiä spektrejä kutsutaan absorptiospektrit.
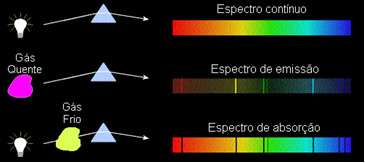
Näiden havaintojen perusteella Kirchoff loi kolme lait spektroskopiaa varten, jotka ovat:
1) ruumis läpinäkymätön kuuma, missä tahansa kolmesta fysikaalisesta tilasta, lähettää spektrin jatkuva.
2) kaasu läpinäkyvä - kuten edellä havaitut jalokaasut - tuottaa a päästöspektri, ulkonäöltään linjat kirkas. Näiden linjojen lukumäärä ja sijainti määräytyvät kaasussa olevien kemiallisten alkuaineiden perusteella.
3) Jos a jatkuva spektri kulkee kaasun läpi alimmassa lämpötilassa kylmä kaasu aiheuttaa tummat viivat, tuo on absorptiospektri. Näin tapahtui natriumkaasun läpi kulkevalle auringonvalolle. Tässä tapauksessa viivojen lukumäärä ja sijainti absorptiospektrissä riippuu myös kaasussa olevista kemiallisista alkuaineista.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Päästö- ja absorptiospektrit ja Kirchhoffin lait"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/espectros-emissao-absorcao-leis-kirchhoff.htm. Pääsy 27. kesäkuuta 2021.