Karbonaatit ovat epäorgaanisia yhdisteitä, jotka muodostuvat metallin tai puolimetallin ionisidoksesta karbonaattianioniin, CO32-.
Hiili on neliarvoinen, ts. Sillä on neljä elektronia valenssikuoressa, ja se voi tehdä neljä kovalenttista sidosta stabiiliksi, kun happi on kaksiarvoinen, sillä valenssikuoressa on kuusi elektronia ja pystyy muodostamaan kaksi sidosta stabiiliksi, kahdeksan elektronit. Täten hiili sitoutuu voimakkaasti kahteen happiatomiin, jotka kaikki ovat stabiileja (O ═ C ═ O → CO2).
Mutta muu happi voi yhdistyä hiilen kanssa, koska ionisäteiden suhde johtaa koordinaatiolukuun, joka on yhtä suuri kuin 3, muodostaen rakenteen kolmion muotoinen, jossa hiili on keskellä, muodostaen kaksoissidoksen yhden happiatomin kanssa ja kaksi yksittäistä sidosta kahden muun kanssa hapettimet. Tuloksena on kaksi ylimääräistä elektronia, koska nämä kaksi oksigeeniä eivät ole stabiileja, ja niiden on vastaanotettava yksi elektroni:
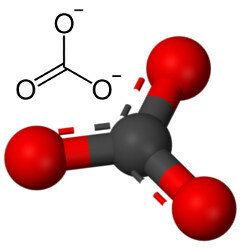
Karbonaattianioni muodostuu kovalenttisista sidoksista, mutta sen yhdisteet, jotka ovat epäorgaanisia suoloja ja mineraaleja karbonaatteina tunnetut ovat ionisia, koska tämä radikaali vastaanottaa kaksi elektronia jostakin metallista tai puolimetallista muodostaen a ionisidos.
Nämä yhdisteet ovat veteen liukenemattomia, lukuun ottamatta ammoniumkarbonaattia ((NH4)2CO3) ja alkalimetallien kanssa muodostetut karbonaatit (ryhmän 1 osat: Li, Na, K, Rb, Cs ja Fr). Lähes kaikki ovat valkoisia kiinteitä aineita, kuten alla olevassa kuvassa näkyy:

Kaksi yleisintä ja tärkeintä jokapäiväistä esimerkkiä karbonaateista ovat natriumkarbonaatti (Na2CO3) ja kalsiumkarbonaatti (CaCO3). Ensimmäisessä tapauksessa natrium kuuluu perheeseen 1, jolla on elektroni valenssikuoressa ja jolla on taipumusta menettää tämä elektroni vakaana. Koska karbonaattianionin on vastaanotettava kaksi elektronia, se sitoutuu kahteen natriumatomiin:
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)

Soodatuhka tunnetaan paremmin nimellä sooda tai sooda, jota käytetään saippuoiden, väriaineiden, lääkkeiden, paperien ja uima-altaan veden käsittelyssä. Mutta sen pääasiallinen käyttö on kalsiumkarbonaattia ja hiekkaa lasin valmistuksessa.
Kalsium on perhe 2, jolla on taipumus menettää kaksi elektronia. Siten kalsiumatomi sitoutuu karbonaattiradikaaliin:

Kalsiumkarbonaattia on kalkkikivessä ja marmorissa. Klo tippukivipylväät ja tippukivipylväät luolissa esiintyvät koostuvat tästä karbonaatista; kuoret, koralliriutat ja munankuoret. Kun kalkimme seinät, puunrungot ja muut paikat, käytämme kalsiumhydroksidia (Ca (OH)2), joka ajan myötä reagoi ilmakehän hiilidioksidin kanssa muodostaen kalsiumkarbonaattia.

Karbonaatit ovat hyvin yleisiä maan pinnalla, kuten mineraalien tapauksessa. Sen kiteinen verkkokalvo voi järjestää itsensä avaruudessa uudelleen kahdella tavalla: ortorombinen (kuten yllä esitetyllä mineraaliaragonitilla yhdessä kalsiumkarbonaattikaavan kanssa) ja rombohedraalinen tai trigonaalinen, kuten kalsiitti (toinen mineraali, joka koostuu kalsiumkarbonaatista).
Karbonaatit reagoivat happojen läsnä ollessa vapauttaen CO: ta2, joka näkyy helposti kuohun läpi.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Karbonaatit"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/carbonatos.htm. Pääsy 28. kesäkuuta 2021.
Kemia

Natriumkarbonaatti, Leblanc-menetelmä, Ernest Solvay -menetelmä, sooda, sooda, tavallisen lasin valmistus, uima-altaan vedenkäsittely, veden pH: n säätö, tekstiilien käsittely, elintarvikelisäaine.
Kemia

Jokapäiväiset suolat, kalsiumkarbonaatti, natriumkloridi, natriumfluoridi, kaliumnitraatti, natriumnitraatti natrium, natriumkarbonaatti, natriumbikarbonaatti, natriumbikarbonaatti, natriumsulfiitti, suolapitoinen sooda.