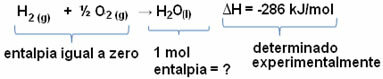
Kuten tekstissä selitetään Ratkaisujen kylläisyys, kemialliset liuokset muodostuvat a liuenneen aineen a liuotin. Jokaisella liuenneella aineella on liukoisuuskerroin spesifinen, mikä on liuenneen aineen enimmäismäärä, joka liukenee tiettyyn määrään liuotinta tietyllä määrällä lämpötila.
Kaavion rakentaminen liukoisuuskäyrällä
Esimerkiksi liukoisuuskerroin KNO: n3 on 31,2 g 100 g: ssa vettä 20 ° C: ssa. Jos liuotetaan täsmälleen tämä määrä kaliumnitraattia 100 g: aan vettä 20 ° C: ssa, kyllästetty liuos. Ylimääräinen määrä tätä suolaa saostuu (muodostaa pohjan rungossa).

Liukoisuuskerroin vaihtelee kuitenkin lämpötilan mukaan. Joten, jos lämmitämme tätä kyllästettyä liuosta KNO-pohjaosalla3, sakka liukenee vähitellen veteen. Katso alla KNO-liukoisuuskerrointen arvot3 100 g: ssa vettä eri lämpötiloissa:
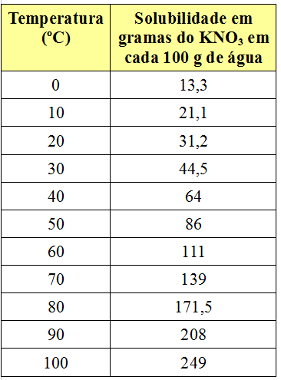
Huomaa, että liukoisuus tämän suolan veteen nousee lämpötilan noustessa. Useimmissa aineissa tämä pätee myös. Jos laitamme nämä arvot a graafinen, meillä on seuraava:
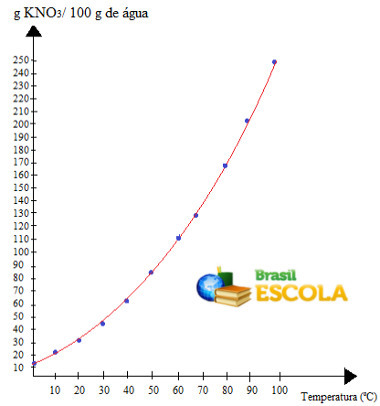
tämä on kutsu liukoisuuskäyrä KNO: n3. Sanomme sen olevan nouseva, koska se kasvaa lämpötilan noustessa.
Liukoisten aineiden liukoisuuskäyrien ominaisuudet kaaviossa
Jokaisella aineella on oma liukoisuuskäyrä tietylle liuottimelle. Joillakin näistä aineista on vähentynyt liukoisuus lämpötilan noustessa, kuten CaCrO: n tapauksessa4, joilla on liukoisuuskäyrä alaspäin. Tämä tarkoittaa, että jos lämmitämme kyllästettyä suolaliuosta, osa liuenneesta suolasta saostuu.
Kuten muillakin aineilla, lämpötilan nousu ei häiritse niin paljon liukoisuutta, kuten tapahtuu pöytäsuolaliuoksen (NaCl) kanssa. 20 ° C: ssa NaCl: n liukoisuuskerroin on 36 g 100 g: aan vettä, mutta jos nostamme lämpötilan 100 ° C: seen, tämä liukoisuus kasvaa vain 39,8 grammaan, mikä on hyvin pieni nousu.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
On myös aineita, joissa liukoisuus kasvaa vain tiettyyn lämpötilan nousun pisteeseen, koska sen jälkeen liukoisuus vähenee. Tämä tapahtuu esimerkiksi hydratoitujen aineiden kanssa, jotka kuumennettaessa saavuttavat dehydratoitumisen ajan. Siksi sen koostumuksen muuttuessa muuttuu myös sen liukoisuuden vaihtelu lämpötilan kanssa. Tämä esiintyminen voidaan havaita kaaviossa liukoisuuskäyrän taivutusten kautta.
Alla esitämme a kaavio liukoisuuskäyrillä erilaisia aineita:
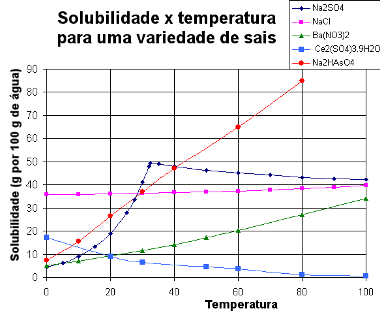
Eri suolojen liukoisuuskäyrät
Tämän tyyppisen kaavion avulla voimme verrata eri suolojen liukoisuutta samaan liuottimeen ja samoissa lämpötiloissa.
Liuoksen luokittelu käyrällä, jolla on liukoisuuskäyrä
Klo liukoisuuskäyrät ne auttavat myös määrittämään liuosten kylläisyyden, eli ovatko ne tyydyttymättömiä, tyydyttyneitä, taustatyydyttyneitä tai ylikylläisiä. Katso esimerkki:
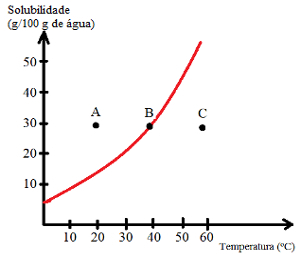
Katso, minkä tyyppisiä ratkaisuja pisteet A, B ja C osoittavat:
V: Kyllästetty pohjarungolla. Pisteessä A 30 g liuotinta liuotetaan 100 g: aan vettä 20 ° C: ssa. Käyrä osoittaa, että tässä vaiheessa liukoisuuskerroin on noin 15 g / 100 g vettä. Siten, kun läsnä olevan liuenneen aineen määrä on suurempi, saadaan kyllästetty liuos pohjakappaleella.
B: Kyllästetty. Piste B sijaitsee täsmälleen liukoisuuskäyrällä, mikä osoittaa, että liuos on kyllästetty, koska 40 g: ssa 100 g: aan vettä on liuotettuna 30 g liuennutta ainetta. Tämä on siis täsmälleen tämän liuenneen aineen liukoisuuskerroin tässä lämpötilassa.
C: Tyydyttymätön. Liukenevaa ainetta on 30 g liuotettuna 100 g: aan vettä 60 ° C: ssa. Käyrä osoittaa, että tässä vaiheessa liukoisuuskerroin on suurempi kuin 50 g / 100 g vettä. Siten, koska liuenneen liuenneen aineen määrä on pienempi kuin liukoisuuskerroin, on tyydyttymätön liuos.
Siten voimme päätellä, että:
Käyrän yläpuolella olevat pisteet: kyllästetyt liuokset, joissa on taustakappale;
Käyrän pisteet: tyydyttyneet liuokset;
Pisteet käyrän alla: tyydyttymättömät liuokset.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Kaaviot liukoisuuskäyristä"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/graficos-das-curvas-solubilidade.htm. Pääsy 28. kesäkuuta 2021.
Kemia

Dissosiaatio ja ionisaatio, italialainen tutkija Volta, sähkövirta, ruotsalainen fyysinen kemisti Svant August Arrhenius, teoria Arrhenius, positiiviset ionit, kationit, negatiiviset ionit, anionit, kaustinen sooda, pöytäsuola, napamolekyylit, dissosiaatio ioninen,