Hapetusreaktiossa tapahtuu elektronihäviöitä, kun taas pelkistysreaktio koostuu elektronien saamisesta.
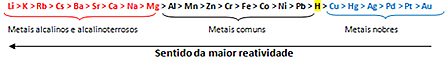
THE Hapetus se voi tapahtua kolmessa tilanteessa: kun aineeseen lisätään happea, kun aine menettää vetyä tai kun aine menettää elektroneja. Esimerkki: hedelmäsalaatit pyrkivät tummumaan joutuessaan kosketuksiin ilman kanssa, koska happi edistää hedelmien hapettumista. Vinkki, ettei tätä tapahtuisi, on lisätä sitruuna- tai appelsiinimehua, koska sitrushedelmissä oleva C-vitamiini estää hapen hapettavan vaikutuksen salaattiin.
THE Vähennyspuolestaan on päinvastainen ja tapahtuu myös kolmella tavalla: kun aine menettää happea, kun se saa vetyä tai kun se saa elektroneja. Esimerkki: kun kuparioksidi (musta) asetetaan sopivaan laitteeseen (kammioon) sen pelkistyksen tapahtumiseksi, vetykaasu tulee sisään kosketuksessa ylikuumentuneen kuparioksidin kanssa ja sen seurauksena se menettää happea ja muuttuu vähitellen vaaleanpunaiseksi, kun se pienenee kupari.
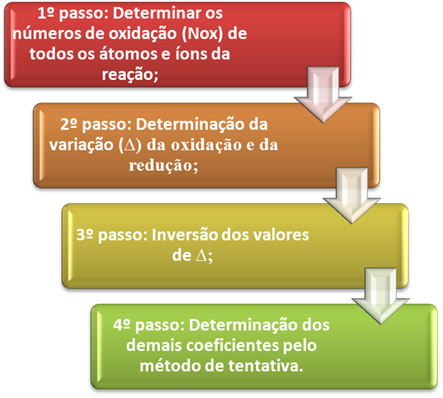
Oksidin pelkistysreaktio: Tiedetään, että hapetus ja pelkistys tapahtuvat yhdessä samassa kemiallisessa reaktiossa. Tätä ilmiötä kutsutaan
Jotkut näistä reaktioista ovat erittäin hyödyllisiä teollisuudelle. Esimerkiksi rauta uutetaan yhdistämällä rautamalmi hiilimonoksidiin (CO) masuunissa. Tässä reaktiossa malmi menettää happea muodostaen rautaa (Fe) ja CO vastaanottaa happea CO: n muodostamiseksi2 (hiilidioksidi). Ruoste on yksi redoksireaktion tuloksista, jossa rauta hapettuu muodostaen rautaoksidia (ruoste) ja ilman happi vähenee.
Toinen esimerkki redox-reaktiosta on hopean kanssa kosketuksessa ilman kanssa. Hopeaesineet menettävät kiiltävän ulkonäönsä ajan myötä, ja niistä tulee tummia ja tummia. Tämä tosiasia johtuu siitä, että kohteen pinnalla olevat hopeaatomit reagoivat muiden aineiden, kuten hapen, kanssa. Sitten sanomme, että hopea on hapettunut, ts. Se on käynyt läpi hapettumis-pelkistysreaktion.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Kirjoittanut Líria Alves
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
SOUZA, Líria Alves de. "Hapetus ja pelkistys"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/oxidacao-reducao.htm. Pääsy 27. kesäkuuta 2021.