Pääasiassa fysikaalisessa kemiassa tutkittuja hapetus-pelkistysreaktioita ovat ne, joissa tapahtuu elektroninsiirtoa. Reagoivat lajit (atomi, ioni tai molekyyli), jotka menettävät yhden tai useamman elektronin, hapetetaan. Elektroneja vastaanottavat kemialliset lajit sen sijaan vähenevät.
Yleensä, kun tämän tyyppistä reaktiota tutkitaan epäorgaanisessa kemiassa, sitä kutsutaan yksinkertainen vaihtoreaktio tai siirtymän.
Jotta reaktio tapahtuisi, on tarpeen täyttää tietyt ehdot. Yksi niistä on, että on oltava kemiallinen affiniteetti reagenssien välillä, toisin sanoen niiden on oltava vuorovaikutuksessa tavalla, joka mahdollistaa uusien aineiden muodostumisen.
Redox-reaktioiden tapauksessa affiniteetti tarkoittaa, että toinen reagoivista pyrkii saamaan elektroneja ja toinen menettämään elektroneja. Tämä suuntaus vastaa reaktiivisuus kemiallisista alkuaineista.
Katsotaanpa, kuinka on mahdollista verrata reaktiivisuutta metallien välillä.
Oletetaan, että haluamme varastoida liuos kupari II -sulfaattia (CuSO
4). Emme voineet mahdollisesti sijoittaa tätä liuosta alumiinisäiliöön, koska seuraava reaktio tapahtuisi:2 Als + 3 CuSO4 (aq)→ 3 Cus + Al2(VAIN4)3 (aq)
Huomaa, että alumiini on hapettunut, menettää 3 elektronia kukin ja siitä tulee alumiinikationia:
Als → Al3+(tässä) + 3 ja-
Samanaikaisesti kuparikationi (Cu2+), joka oli liuoksessa, sai elektroneja alumiinista ja pelkistyi metallikupariksi. Jokainen kuparikationi saa kaksi elektronia:
Perse2+(tässä) + 2 ja- → Cus
Jos se olisi kuitenkin päinvastoin ja halusimme tallentaa alumiinisulfaattiliuoksen (Al2(VAIN4)3 (aq)), ei olisi ongelma laittaa se kuparisäiliöön, koska tätä reaktiota ei tapahdu:
Perses + Al2(VAIN4)3 (aq) → ei tapahdu
Nämä havaitut tosiasiat voidaan selittää sillä, että alumiini on reaktiivisempi kuin kupari.
Metallilla on taipumus luopua elektronista eli hapettua. Eri metalleja verrattaessa se, jolla on suurin taipumus luovuttaa elektroneja, on reaktiivisin. Näin ollen metallien reaktiivisuus liittyy myös niiden reaktiokykyyn ionisaatioenergia, ts. vähimmäisenergia, joka tarvitaan elektronin poistamiseksi kaasutomista sen perustilassa.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)

Tämän perusteella metallireaktiivisuusjono tai elektrolyyttisten jännitteiden rivi, nähtävissä alapuolella:
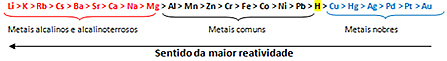
Reagoivin metalli reagoi ionisten aineiden kanssa, joiden kationit ovat vähemmän reaktiivisia. Toisin sanoen vasemmalla oleva metalli reagoi sen oikealla puolella olevien ionien muodostaman aineen kanssa. Päinvastoin ei tapahdu.
Muistaessasi annettu esimerkki, katso reaktiivisuusriviltä, että alumiini (Al) on kuparin vasemmalla puolella (Cu). Siksi alumiini reagoi kuparikationien muodostaman liuoksen kanssa; mutta kupari ei reagoi alumiinikationien muodostaman liuoksen kanssa.
Huomaa, että reaktiivisin metalli on litium (Li) ja vähiten reaktiivinen kulta (Au).

Tämä on yksi syy siihen, miksi kulta on niin arvokasta, koska jos se ei reagoi, se pysyy ehjänä pitkään. Tämä näkyy kullalla päällystetyissä egyptiläisissä sarkofageissa ja veistoksissa, jotka juontavat juurensa kaikkein kaikkein antiikin aikoihin. Visualisoimme tämän myös vertaamalla puhtaan kultakorun kestävyyttä koruihin, jotka on valmistettu muista metalleista, jotka ovat reaktiivisempia kuin kulta.

Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Metallien reaktiivisuuden järjestys"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/ordem-reatividade-dos-metais.htm. Pääsy 28. kesäkuuta 2021.


