O tasapainotetaan hapetus-pelkistysyhtälö se perustuu luovutettujen elektronien määrän ja vastaanotettujen elektronien lukumäärän tasa-arvoon. Yksinkertainen tapa suorittaa tämä tasapainotus annetaan seuraavilla vaiheilla:
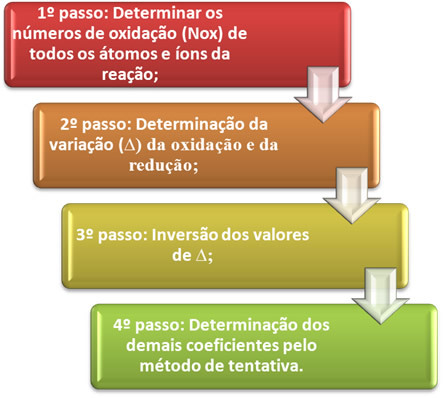
Katsotaan käytännössä näiden vaiheiden soveltamista seuraavan esimerkin avulla:
Reaktio kaliumpermanganaatin vesiliuoksen ja suolahapon välillä:
kmnO4 + HCI → KCl + MnCl2 + Cl2 + H2O
*1. askel:Määritä hapetusnumerot:
Tämä vaihe on tärkeä, koska emme yleensä pysty nopeasti visualisoimaan, mitkä lajit hapettuvat ja pelkistyvät.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCI → KCl + MnCl2 + Cl2 + H2O
*2. vaihe:Hapettumisen ja pelkistymisen vaihtelun määrittäminen:

Huomaa, että mangaani (Mn) pelkistyy ja kloori (Cl) hapetetaan.
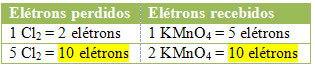
MnCl2 = ∆Nox = 5
Cl2 = ∆Nox = 2
Kloorin tapauksessa voimme huomata, että HCl tuotti 3 yhdistettä (KCl, MnCl2ja Cl2), mutta mielenkiintoinen on Cl2, koska Nox on kärsinyt vaihteluista. Jokainen kloori, joka muodostaa Cl: n2 menettää yhden elektronin; koska kunkin kloridin muodostamiseksi tarvitaan 2 klooria2, sitten kaksi elektronia menetetään.
3. vaihe:∆-arvojen kääntäminen:
Tässä vaiheessa ∆: n arvot vaihdetaan mainittujen lajien kesken, jolloin niistä tulee kertoimet:
MnCl2 = ∆Nox = 5 → 5 on Cl: n kerroin2
Cl2 = ∆Nox = 2→ 2 on MnCl-kerroin2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
Tässä vaiheessa on jo mahdollista tietää yhtälön kaksi kerrointa.
Havainto: normaalisti useimmissa reaktioissa tämä arvojen kääntäminen suoritetaan 1. jäsenelle. Mutta pääsääntöisesti tämä tulisi tehdä jäsenessä, jolla on eniten redoksia läpikäyviä atomeja. Jos tätä kriteeriä ei voida täyttää, käännetään arvot jäsenelle, jolla on eniten kemiallisia lajeja. Näin tehtiin täällä, koska 2. jäsenellä on enemmän aineita.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
4. vaihe: Koetasapainotus:
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Koska toisessa jäsenessä on kaksi mangaaniatomia, kuten kerroin osoittaa, ensimmäisessä on myös oltava. Joten meillä on:
2 kmnO4 + HCI → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Siten kaliumin (K) määrä ensimmäisessä jäsenessä oli 2, mikä on sama kerroin tälle atomille toisessa jäsenessä:
2 kmnO4 + HCI → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- Kloorin (Cl) määrä toisessa jäsenessä on yhteensä 16, joten ensimmäisen jäsenen HCl-kerroin on:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- Vetyjen määrä ensimmäisessä jäsenessä on 16, joten veden kerroin (H22. jäsenen O) on yhtä suuri kuin 8, koska vetyindeksin (2) kerroin 8: lla on yhtä suuri kuin 16:
2 kmnO4 + 16 HCI → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
- Voit tarkistaa, onko yhtälö oikein tasapainossa, näemme kaksi kriteeriä:
1.) Tarkista, onko kunkin atomin määrä kahdessa jäsenessä yhtä suuri:
2 kmnO4 + 16 HCI →2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2.) Katso onko menetettyjen elektronien kokonaismäärä yhtä suuri kuin vastaanotettujen elektronien kokonaismäärä:
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Roxi-pelkistyksen tasapainotus"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm. Pääsy 28. kesäkuuta 2021.


