Elektrolüüs on keemiatööstuses laialdaselt kasutatav protsess, kuna see võimaldab seda saada ained, mida looduses vaba pole, näiteks kloor, jood, seebikivi teised.
Elektrolüüs on vastupidine elemendile, kus elektrit saadakse redoksreaktsioonide abil, see tähendab, et keemiline energia muundatakse elektrienergiaks. Juba elektrolüüsis kasutatakse elektrit redoksreaktsioonide ja keemilise energia tootmiseks.
Siit tuleneb ka selle nime päritolu elektro tähendab "elektrivoolu" ja lüüs tähendab "murda". Täpselt nii juhtub, elektrivool purustab või lagundab sellele alluvat ainet.
Aku on spontaanne protsess, elektrolüüs see on mittespontaanne protsess, mis tuleb käivitada elektrivoolu abil.
Elektrolüüsi on kahte tüüpi: a tuline ja vesikeskkonnas. Selles tekstis käsitleme esimest juhtumit.
Tardelektrolüüsi ja vesikeskkonnas toimuva elektrolüüsi erinevus seisneb selles, millises vormis on elektrivoolule allutatud aine. Tardelektrolüüsi korral on ioonne aine vedelas olekus, see tähendab sulanud, ilma vee olemasoluta.
Sõna "tuline" pärineb ladina keelest tuline, mis tähendab "põletav, põletikuline".Elektrolüüsil kasutatakse konteinerit, mida nimetatakse a Kuuba või elektrolüütiline element, kus on paigaldatud kaks elektroodi, mille kaudu elektrivool läbib. Elektroodid võivad olla inertne (elektrolüüsi ajal ei muutu) või aktiivne (Elektrolüüsi käigus kannatavad nad mingisuguste muutustega). Enim kasutatakse plaatinast või grafiidist valmistatud inertse.
Seejärel ühendatakse elektroodid alalisvooluallikaga (element või aku). Aku negatiivne poolus varustab elektrone ühega elektroodidest, muutudes negatiivselt laetud ja meelitab sulanud aine katioone (positiivseid ioone). Kuna see meelitab katioone, nimetatakse seda negatiivset elektroodi katoodiks. Selles saavad katioonid elektrone ja redutseerivad.
Positiivne elektrood meelitab anioone (negatiivseid ioone) ja seetõttu nimetatakse seda anoodiks. Anioonid vabastavad oma elektronid anoodist, olles oksüdeerunud.
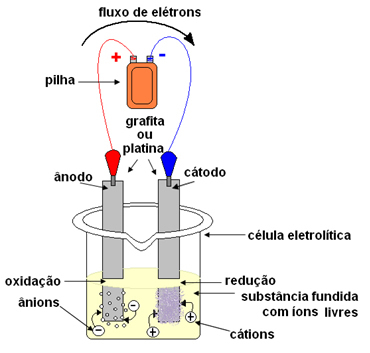
Patareides nimetatakse positiivset elektroodi katoodiks ja negatiivseks anoodiks. Siin on elektrolüüsil vastupidine, anood on positiivne poolus ja katood on negatiivne poolus. Kuid mõlemal juhul toimub aku ja elektrolüüsi korral anoodi juures oksüdeerumine ja katoodi juures reduktsioon.
Lühidalt, meil on:

Teine oluline asjaolu on see, et elektrivoolu genereerimiseks kasutatava elemendi või aku ddp (potentsiaalide vahe) peab olema võrdne või suurem kui reaktsioonipotentsiaalide erinevus.
Et paremini mõista, kuidas toimub elektrolüüs ja kuidas see lagundab olulisi elemente tekitavaid aineid või lihtsaid aineid, lugege teksti Tardne naatriumkloriidi elektrolüüs.
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea.htm