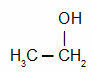Oksiidid on binaarsed ühendid, st moodustuvad vaid kahest keemilisest elemendist, millest kõige elektronegatiivsem on hapnik. Allpool leiate mõned kõige olulisemad oksiidid, mis meie igapäevases elus esinevad:
- Kaltsiumoksiid (CaO):
See ühend on valge pulber, mida tuntakse kustutamata lubjana või kustutamata lubjana, mis veega reageerimisel annab kaltsiumhüdroksiidi (Ca (OH))2), tuntud kui kustutatud lubi, kustutatud lubi või hüdraatunud lubi. Seda alust kasutatakse seinte valgendamiseks, et kaitsta seda sissetungimise eest, ja puudel putukate tõrjumiseks.

Kaltsiumoksiidi kasutatakse põllumajanduses laialdaselt happeliste muldade pH korrigeerimiseks. Kuid selle rakendamise viis peab olema ettevaatlik, sest CaO reageerib meie nahal oleva veega ja tekitab põletushaavu. Lisaks põhjustab see ka hingamisteede kahjustusi ja võib põhjustada pimedaksjäämist.
Muud CaO rakendused on: konstruktsioonides, mördi, tsemendi ja keraamika valmistamisel; metallurgiatelliste tootmisel, vee ja kanalisatsiooni töötlemisel, insektitsiidi ja fungitsiidina, suhkrute, taimeõlide ja puuviljamahlade puhastamisel, klaasi, Na
2CO3 ja CaCl (ClO).- Magneesiumoksiid (MgO):
MgO on laialdaselt kasutatav valge pulber, mis on segatud veega, moodustades magneesiumpiimana tuntud lahuse. Seda kasutatakse mao antatsiidina, kuna see reageerib meie maos sisalduva soolhappega ja neutraliseerib keskkonda.

- Ränioksiid (SiO2):
SiO2 seda tuntakse ränidioksiidina ja seda on liivas ning seda leidub ka kristalsel kujul, näiteks kvarts, topaas ja ametüst.

Liiva ränidioksiidi kasutatakse klaasi tootmisel koos soodaga (Na2CO3) ja lubjakivi (CaCO3). Kui neid ühendeid kuumutatakse temperatuurini 1500ºC, moodustub naatrium- ja kaltsiumsilikaatide segu, mis jahutatakse meile teadaoleva klaasi saamiseks.
Ärge lõpetage kohe... Peale reklaami on veel;)
Kell2CO3 + CaCO3 + SiO2 → naatrium- ja kaltsiumsilikaadid
tuhk + lubjakivi + liiv → klaas

- Süsinikmonooksiid (CO):
Süsinikmonooksiid on saastav ja äärmiselt mürgine gaas, mis eraldub mittetäielikul põlemisel. Selle gaasiga kokku puutumine võib toimuda fossiilkütuste, näiteks naftatoodete ja sigaretisuitsu põletamisest põhjustatud reostuse kaudu.

CO kasutatakse terasetehastes ka metallraua tootmiseks, vähendades hematiidist raudoksiidi III.
- süsinikdioksiid (CO2 - tuntud kui süsinikdioksiid):
Ta on üks peamisi vastutajaid selliste keskkonnaprobleemide eest nagu kasvuhooneefekt, globaalne soojenemine ja happevihmad. See eraldub süsinikku sisaldavate kütuste täielikul põlemisel ja ka meie hingamise kaudu.
See on karastusjookides ja gaseeritud vees sisalduv gaas. Tahkes olekus nimetatakse seda kuivjääks ja selle sublimatsiooniomaduse, st möödumise tõttu otse tahkest olekust gaasilisse olekusse eraldab see valge suitsu, mida kasutatakse sageli kontsertidel, teatrites, pidudel ja filmid.
- Vesinikperoksiid (H2O2):
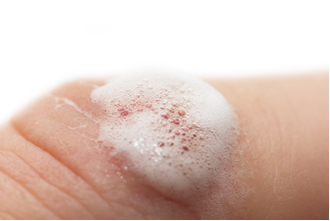
Vesilahuses nimetatakse vesinikperoksiidi vesinikperoksiidiks ja seda kasutatakse (3%) antiseptilise ja valgendajana. Suuremates kontsentratsioonides kasutatakse seda juuste ja juuste kergendamiseks; ja kontsentratsioonides üle 30% kasutatakse seda sellistes tööstusharudes nagu puiduvalgendaja, tekstiilkiud ja raketiliikumine.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Igapäevaelu peamised oksiidid"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/principais-Oxidos-cotidiano.htm. Juurdepääs 28. juunil 2021.
Keemia

Binaarseid ühendeid, peroksiide kasutatakse selgitajatena, riide pleegitajatena, tselluloosimassina, mördi valmistisena, kustutamata lubina, kuivjää, vesinikperoksiidi, vesinikperoksiidina.
Keemia

Lämmastikoksiid, lipofiilne, sünteesitud endoteelirakkudes, gaasiliste vabade radikaalide protsessides rakusisene ja -väline, hemodilatsioon, veresoonte laiendamine lihastes, toidulisandid toit.