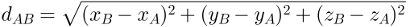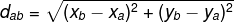THE aktiveerimisenergia see on minimaalne energiakogus, mis on vajalik reaktiivi osakeste kokkupõrkes, mis on sooritatud soodsas suunas, ja põhjustaks reaktsiooni.
Reaktsioonid toimuvad ainult siis, kui reaktantidel on aktivatsioonienergia (või minimaalne vajalik energia, mis varieerub reaktsiooniti; kas koguses või kujul) või kui seda neile tarnitakse.
Näiteks kui metalliline naatrium puutub kokku veega, reageerib see ägedalt. See tähendab, et nende reaktiivide energiasisaldus on reaktsiooni toimumiseks juba piisav.
Ahju sisselülitamise korral toimub põlemisreaktsioon ainult siis, kui asetame ahju eralduva gaasi lähedale süütatud tiku või mõne muu tuleallika. See tähendab, et antud juhul oli vaja süsteemi varustada energiaga, nii et see jõudis aktiveerimisenergiani ja reaktsioon toimus.
Kui fosforit kasutatakse põlemiseks, annab aktiveerimisenergia hõõrdumine. Sama juhtub tulemasinate puhul, mis vajavad ka sädet, mis annab vajaliku aktiveerimisenergia neis sisalduva gaasi põlemiseks.
Aktiveerimisenergiat võib anda ka valguse abil, nagu vesinikperoksiidi lagunemisel. Seetõttu hoitakse seda pimedates või läbipaistmatutes pudelites.

Seega võime järeldada, et aktiveerimisenergia (Eaastani) on reaktsiooni käivitamiseks vajaliku energia erinevus (E) ja reaktiivides sisalduv energia (Epr):

Aktiveerimisenergia on takistuseks reaktsiooni toimumisele ja seda on vaja reaktiivide sidemete purustamiseks. Sellega toimub reaktsioon ja toodete moodustamiseks luuakse uued ühendused.
Kui soodsa orientatsiooniga reagentide osakeste kokkupõrge toimub võrdse energia või aktivatsioonienergiast kõrgemal moodustub enne saaduste moodustumist vahepealne ja ebastabiilne olek, vääringustatud kompleks aktiveeritud, milles reaktiivühendused on nõrgenenud ja moodustuvad tootesidemed. Seega aktiveerimisenergia on energia, mis on vajalik aktiveeritud kompleksi moodustamiseks.
Allpool on graafik, mis näitab aktivatsiooni energiat kui takistust reaktsiooni toimumisele:

Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/energia-ativacao.htm