anorgaanilised soolad need moodustuvad vähemalt ühe katiooni (mis on moodustatud mis tahes metalli või ammooniumi abil) ja aniooni (lihtsa või ühendi) ioonse ühendamise teel.
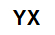
Soola üldmolekulaarne valem
Vette lisamisel soolad dissotsieeruvad, vabastades vähemalt ühe muu katiooni kui hüdroonium (H+) ja muud anioonid kui hüdroksiid (OH-).
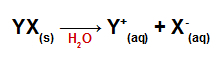
Mis tahes soola dissotsiatsioonivõrrand
Soolade klassifikatsioon
Sooladel võib üldiselt olla järgmine klassifikatsioon:
lihtne sool: sool, mis on moodustatud ainult ühest katioonist ja ühest anioonist. Näited: NaCl, CaSO4, KCN, NH4CO3 jne.
Hüdrogeenitud sool: sellel on kaks katiooni (millest üks peab olema hüdroonium) ja anioon. Näited: NaHCO3, CaHBO3 jne.
Hüdroksüülsool: sellel on katioon ja kaks aniooni (üks neist peab olema hüdroksiid). Näited: MgOHCl, Al (OH)2ClO3 jne.
Hüdreeritud sool: esitleb selle kristallstruktuuriga seotud veemolekule. Näited: CaCl2.2H2O, CuSO46H2Jne.
Topeltsool: sellel on kaks katiooni (kõik erinevad hüdrooniumist) ja üks anioon või üks katioon ja kaks aniooni (kõik erinevad hüdroksiidist). Näited: tüüp4CN, AgFeBO3 jne.
Alum: kas sool moodustub kahest sulfaadist, mille NOx-katioonid on võrdsed +1 ja +3, millele lisandub 24 molekuli vett. Näited: Ag2AINULT4.Al2(AINULT4)3.24H2peal2AINULT4.Sb2(AINULT4)3.24H2O
Soola nimetamise reegel
Aniooni nimi + de + katiooninimi
→ K3TOLM4
Sool sisaldab fosfaatiooniooni (PO4-3) ja kaaliumkatioon (K+1), seega on selle nimi kaaliumfosfaat.
→ Juhtum3
Soolal on sulfitioonioon (SO3-2) ja kaltsiumkatioon (Ca+2), seega on selle nimi kaltsiumsulfiit.
MÄRGE: Kui katioon ei ole hõbe, tsink ega element, mis kuulub perekondadesse IA, IIA ja IIIA, peame katiooni nime ees selle NOX tähistama rooma numbriga.
→ Cu2AINULT4
Soolal on sulfaatioonioon (SO4-2) ja kaltsiumkatioon (Cu+1), seega on selle nimi vasksulfaat I.
Hüdrogeenitud sool: Selle soola jaoks peame enne aniooninime kirjutama valemis vesiniku kogusele viitava eesliite. See eesliide peab olema sõnast eraldi vesinik sidekriipsuga.
→ NaHCO3
Soolal on vesinik, karbonaatanioon ja naatriumkatioon, seega on selle nimi naatriumvesinikkarbonaat.
Hüdroksüülsool: Selle soola jaoks peame enne aniooninime kirjutama valemis hüdroksüülide kogusele viitava eesliite. See eesliide peab olema sõnast eraldi hüdroksü sidekriipsuga.
→ Al (OH)2ClO3
Soolal on kaks hüdroksüülrühma, kloraatioonioon ja alumiiniumkatioon, seega on selle nimi alumiiniumdihüdroksükloraat.
Hüdreeritud sool: Selle soola jaoks peame katiooni nime järele valemis kirjutama veemolekulide hulgale viitava eesliite. See eesliide peab olema sõnast eraldi hüdreeritud sidekriipsuga.
→ CaCl2.2H2O
Soolal on kaks veemolekuli, kloriidioonioon ja kaltsiumkatioon, nii et selle nimi on kaltsiumkloriiddihüdraat.
Topeltsool kahe katiooniga: Selle soola jaoks peame aniooni nime järele sulgudesse kirjutama kahekordse sõna ning seejärel kõige elektropositiivsema katiooninime ja teise katiooni.
→ AgFeBO3
Sellel soolal on lisaks boraatioonioonile hõbe (rohkem elektropositiivset katiooni) ja raud II katioon. Selle nimi on hõbe ja raud II boraat (topelt).
-
Topeltsool kahe aniooniga:
Enamiku elektronegatiivse aniooni nimi + sidekriips + vähima elektronegatiivse aniooni nimi + de + katiooni nimi
→ Tüüp4CN
See sool sisaldab lisaks fosfaadile (rohkem elektronegatiivset aniooni) ja tsüaniidanioonile titaan IV katiooni. Selle nimi on titaantsüaniidfosfaat IV.
Alumiini sool: Selle soola puhul eirame üldreeglit. Kirjutage lihtsalt termin alum, millele järgneb vastavalt +3 laengkatiooni nimi ja +1 laengkatiooni nimi, eraldatud sidesõnaga e.
→ Sisse2AINULT4.Sb2(AINULT4)3.24H2O
Maarjasoolal on +3 antimonkatioon ja +1 naatriumkatioon, nii et selle nimi on antimon III maarja ja naatrium.
Soolade füüsikalised omadused
Need on toatemperatuuril tahked;
Neil on kõrged sulamis- ja keemistemperatuurid;
Need moodustuvad ioonsidemetest;
Nad juhivad elektrivoolu vedelas olekus (pärast liitmist) või vees lahustatuna;
Üldiselt on need vees lahustuvad, kuid on soolasid, mida peetakse praktiliselt lahustumatuteks.
Soolade keemilised omadused
Soolad on ühendid, millel on võime keemiliselt reageerida (eeldusel, et neil ei ole sama katiooni ega sama aniooni kui teisel ainel) mitme ainerühmaga, nimelt:
Topeltvahetusreaktsioonis happega: nad moodustavad uue soola ja uue happe.
Topeltvahetusreaktsioonis alusega: nad moodustavad uue soola ja uue aluse.
Sees topeltvahetusreaktsioon teise soolaga: moodustavad kaks uut soola.
Mõnel soolal on võime kannatada lagunemine kuumuse all moodustades kaks või enam uut ainet. Kui kuumutame naatriumvesinikkarbonaati (NaHCO3) näiteks laguneb, moodustades naatriumkarbonaadi (Na2CO3), vesi (H2O) ja süsinikdioksiid (CO2).
Minu poolt. Diogo Lopes Dias
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-sais-inorganicos.htm



