THE Keemiline kineetika on valdkond, mis uurib keemiliste reaktsioonide arengukiirust mõjutavaid tegureid, see tähendab nende toimumise kiirust. Selle piirkonna ümber tehakse üha rohkem uuringuid, kuna soovime sageli mõnda reaktsiooni kiirendada või teisi aeglustada. See on eriti oluline tööstusharude jaoks ja sellel uuringul on olulised tehnoloogilised tagajärjed.
Kuid kuna reaktsiooni kiirus võib igal ajaintervallil ja ainel erineda, on tavaks arvutada keskmine reaktsioonikiirus.
Mõelge järgmisele üldisele reaktsioonile, kus koefitsiendid on väikesed tähed ning reaktiivid ja tooted on tähistatud suurtähtedega:
a A + b B → c C + d D
Antakse selle reaktsiooni keskmine kiirus mis tahes reageeriva aine keskmise reaktsioonikiiruse või mõne toote keskmise moodustumiskiiruse jagamine keemilise võrrandi vastava koefitsiendiga. Selle annab:
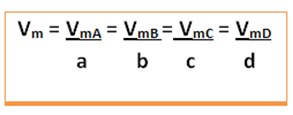
Näiteks kaaluge vesinikperoksiidi lagunemisreaktsiooni:
2 tundi2O2 (aq) → 2 H2O(1) + 1 O2 g)
Oletame, et 1 minuti jooksul tekkis 0,3 mol / l H2O ja 0,15 mol / l O
2, samal ajal kui 0,3 mol / l H lagunes2O2, see tähendab, et nende ainete lagunemise ja moodustumise keskmised kiirused reaktsioonis on:VmH202 = 0,3 mol / l. min
VmH20 = 0,3 mol / l. min
VmO2 = 0,15 mol / l. min
Ülemaailmse reaktsiooni keskmine kiirus leitakse, võttes ühe neist väärtustest ja jagades selle võrrandi vastava koefitsiendiga:
Vm = VmH202 = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmH20 = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmO2 = 0,15 mol / l. min = 0,15 mol / l. min
1 1
Pange tähele, et kolm väärtust on võrdsed, seetõttu on reaktsioonikiirus sama mis mis tahes reagendi või toote funktsioon, samas ajavahemikus.
Kuidas aga leiti nende reaktsioonides osalevate ainete keskmise kiiruse väärtused?
Seda saab arvutada aine (reaktiivi või toote) kontsentratsiooni kõikumise jagamine ajaintervalliga. Kui kavatseme kindlaks määrata ühe kiiruse keskmise kiiruse reaktiivid reaktsioonist peame panema a negatiivne märk enne kaaluda kontsentratsiooni väärtust moodulis ||, kuna reaktiivi kontsentratsioon aja jooksul väheneb, oleks kiiruse väärtus negatiivne, kuid negatiivset kiirust pole.

Näiteks kaaluge järgmist osoonigaasi lagunemisreaktsiooni (O3 g)) hapnikugaasis (O2 g)):
2 O3 g) → 3 O2 g)
Oletame, et õhupallis oli 10 mooli osoongaasi, kuid 1 minuti pärast oli järele jäänud vaid 4 mooli; see tähendab, et 6 mooli osooni muutus hapnikugaasiks. Nii et meil on:
2 O3 g) → 3 O2 g)
t = 0 min 2 mol / L 0 mol / L
moodustunud kulud
6 mol / L 9 mol / L
t = 1 min 4 mol / L 9 mol / L
Pange tähele, et kuna reaktsioonisuhe on 2: 3, siis kui kasutada 6 mooli O-d3Moodustati 9 mol O-d2. Nii et ühe minuti pärast on meil järgmised keskmised kiirused:
Vm = - ∆ [3]
t
Vm = - ([O3finaal - O3 algne])
tLõplik - tinitsiaalne
Vm = - ([4 - 10])
1– 0
Vm = 6 mol / l. min→ 1 minuti jooksul reageeris süsteemi igas liitris 6 mol osooni.
Vm = ∆ [2]
t
Vm = ([O2finaal - O2 algset])
tLõplik - tinitsiaalne
Vm = ([9 - 0])
1– 0
Vm = 9 mol / l. min→ 1 minuti jooksul tekkis süsteemi igas liitris 9 mooli hapnikku.
See näitab meile, et saame keskmise kiiruse arvutada reaktantide või saaduste funktsioonina.
Kui tahame arvutada selle globaalse reaktsiooni keskmise kiiruse, tehke lihtsalt nii, nagu näitasime alguses: jagage kõik need kiirused keemiliste võrrandite vastavate koefitsientidega:
Vm = Vm03 = 6 mol / l. min = 3 mol / l. min
2 21
Vm = VmO2 = 9 mol / l. min = 3 mol / l. min
3 3
Vm = Vm03 = VmO2
23
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm

