Teadlane Friedrich Kohlrausch (1840-1910) tegi esimesena ettepaneku, et puhas vesi juhib elektrit, ehkki väikeses mahus. Seda seetõttu, et vesi käitub amfoteersel viisil; see tähendab, et teatud juhtudel toimib see nagu hape, annetades prootoneid (H+); ja teistes käitub see kui alus, saades prootoneid.
See tähendab, et vesi teostab ise ionisatsiooni vastavalt allpool toodud keemilisele võrrandile:
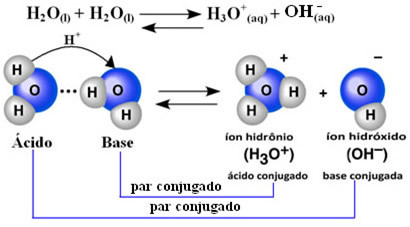
Seda protsessi nimetatakse vee autoionisatsioon ja see toimub väga väikeses mastaabis, see tähendab, et vesi on väga nõrk elektrolüüt, mille ionisatsiooniastme ja ionisatsioonikonstantide tasakaal on madal (Kç). Täpselt seetõttu on vee juhtivus nii madal.
Idee saamiseks on ümbritseva õhu temperatuuril 25 ° C võimalik kindlaks teha, et puhta vee eneseioniseerimisel tekkivad hüdroksiidi ja hüdrooniumiioonide kontsentratsioonid on võrdsed 1-ga. 10-7 mol. L-1. See tähendab, et miljardist veemolekulist ioniseerub ainult kaks.
Vee ioonilise tasakaalu konstanti nimetatakse çvee dissotsiatsioonikonstant,autoprotolüüsi konstant
või ioonne vee produkt.Seda konstandit esindab Kw, kuna w tähistab seda sõna vesi, mis inglise keeles tähendab vett.Selle arvutamine toimub samamoodi nagu teised tasakaalukonstandid, pidades seda meeles, nagu on öeldud tekstis Tasakaal Kc ja Kp ”, sel juhul ilmuvad avaldises ainult tooted, kuna vedelas vees on sama aktiivsus kuni 1. Puhtaid vedelaid või tahkeid aineid ei lisata dissotsiatsioonikonstandi väljendusse, kuna need ei muutu. Asetatakse ainult vesilahused ja gaasilised lahused. Nii et meil on:
Kw = [H3O+]. [oh-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Nagu teiste tasakaalu konstantide puhul, Okeiw see muutub ainult temperatuuri muutusega. Vee temperatuuri tõustes suureneb ka selle ionisatsioon, mis tähendab, et vee eneseioniseerimine on endotermiline protsess, see tähendab, et see neelab soojust.
Seda võib näha vee ioonproduktide väärtustest (Kw), mis on toodud allolevas tabelis erinevatel temperatuuridel:
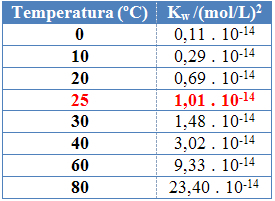
Vee ioonsaadusel on igal temperatuuril alati fikseeritud väärtus, olgu siis puhtas vees või lahuses. Isegi kui lahuses on H-ioonide kontsentratsioonid3O+ ja oh- erinev, jääb nende vaheline toode konstantseks.
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm
