THE teneso (või tennesso), sümbol Ts, on element number aatomiline 117 perioodilise tabeli. Selle avastus oli väga hiljuti, 2009. aastal, ja see lisati perioodilisustabelisse alles 2015. aasta lõpus. Seda ei leidu looduses ühegi isotoobi kujul ja seetõttu tuleb seda toota laboris, kuna see on sünteetiline keemiline element.
Tennesso omadusi uuritakse endiselt teoreetilise keemia ja matemaatiliste arvutuste abil, arvestades selle madalat tootmiskiirust. Selle tootmine toimub vahelise reaktsiooni kaudu 48Ca ja 249Bk, mis võimaldab toota elemendi 294 või 293 isotoopi.
Nimi viitab USA Tennessee osariigile, kust on pärit mõned isotoobi avastamise ja tootmisega seotud teadlased. 249Bk, nii oluline selle uue elemendi sünteesiks.
Vaata ka: Bohrium on veel üks sünteetiline keemiline element, millel on madal tootmismäär
Tennesso kokkuvõte
Tenesso on sünteetiline keemiline element, mis asub rühmas 17 Perioodilisustabel.
See sünteesiti esmakordselt 2009. aastal Venemaa ja Ameerika teadlaste ühistöös.
Seda kinnitasid sõltumatult Saksa teadlased.
See moodustab 2016. aastal perioodilisustabelisse viimati lisatud elementide rühma.
Selle uuringud on veel väga hiljutised ja selle omadused on kindlaks määratud matemaatiliste meetoditega.
Selle tootmine on Tuumasünteesi, kasutades ioone 48Ca ja selle aatomid 249bk.
Selle nimi viitab USA Tennessee osariigile.
tennesso omadused
Sümbol: Ts.
Aatomnumber: 117.
Aatommass: 293 c.u. või 294 c.u. (ei ole Iupaci ametlik).
Elektrooniline konfiguratsioon: [Rn] 7s2 5f14 6d10 7p5.
Kõige stabiilsem isotoop:294Ts (51 millisekundit pool elu, mis võib erineda 38 millisekundit rohkem või 16 millisekundit vähem).
Keemiline seeria: rühm 17, halogeenid, ülirasked elemendid.
Tenesso omadused
Tennesso (või tennesso), sümbol Ts, oli üks neljast viimasest ametlikuks muutvast elemendist Rahvusvahelise Puhta ja Rakenduskeemia Liidu (IUPAC) poolt oma perioodilises tabelis. Aatomnumbriga 117 asub see rühmas 17 halogeenid.
Seda toodeti esmakordselt aastatel 2009–2010, kuid selle kinnitamine Iupaci poolt toimus alles 30. detsembril 2015. aastal. Sellise suurusega elemendid aatomnumber ja arv neutronid looduses ei leidu ja need tuleb luua laboris, seega on see a sünteetiline keemiline element.
Peamine põhjus, miks neid looduses ei leidu, on see, et nad on äärmiselt ebastabiilsed. Kui need on toodetud tuumareaktsioonide kaudu, läbivad need radioaktiivne lagunemine mõne sekundiga (mõnikord vähem kui see, millisekundite vahemikus).
Lisaks toodetakse selliseid elemente nagu T-d aeglaselt, koos madal saagikus. Täpsemalt tenesso puhul hoidsid teadlased reaktsiooni 70 päeva, et tuvastada selle elemendi kuus aatomit.
Seetõttu püüavad teadlased praegu teoreetiliste arvutuste ja matemaatiliste mudelite abil kindlaks teha Ts ja mõnede selle ühendite põhiomadused. aastal läbi viidud ja avaldatud uuringus Keemilise füüsika kirjad, Brasiilia teadlane Robson Fernandes de Farias hindas mõningaid Ts füüsikalisi omadusi ja tennesso, TsH, nagu kovalentne raadius, polariseeritavus, kovalentse sideme kaugus, aga ka sideme energia kovalentne.
Tea rohkem: Oganessoon – perioodilises tabelis kõrgeima aatomarvuga keemiline element
teneso saamine
Ülirasked elemendid, nagu teneso, saadakse tehnikaga, mida nimetatakse kuum termotuumasünteesi reaktsioon (tasuta tõlge kuum termotuumasünteesi reaktsioon). Selle tehnika puhul kasutatakse tavaliselt ioone 48Ca, stabiilne isotoop kaltsium, mille loomulik arvukus on 0,2% ja kaheksa neutronit rohkem kui tavaline isotoop.
Ts puhul ioonid 48Ca reageeris isotoobiga 249Bk, aktiniid. Seega esialgu 297Ts, mis lagunes kiiresti ja kaotas kolm või neli neutronit, moodustades isotoobid 294Ts ja 293Ts.
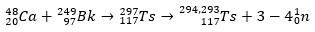
Seda kõike oli võimalik kontrollida α lagunemisahelate analüüs, mis jõudis dubnium ja röntgen. Kuna saadud Ts isotoobid on ebastabiilsed, läbivad nad spontaanselt α-lagunemisreaktsiooni või see tähendab, et nad kiirgavad α-osakest (millel on kaks prootonit ja kaks neutronit), kuni jõuavad stabiilsete tuumadeni.
Lagunemisjälje abil suutsid teadlased pusle kokku panna ja seega üliraske elemendi olemasolu kinnitada. isotoobi jaoks 293Ts, oli kolm α lagunemist kuni 281Rg, samas isotoobi jaoks 294Ts oli kuus α lagunemist kuni 270DB
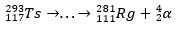
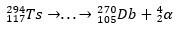
teneso ajalugu
Element 117, esimest korda, sündis Venemaa ja Ameerika teadlaste ulatusliku rahvusvahelise koostöö kaudu, mis toimus Venemaal Dubna linnas Tuumauuringute Ühisinstituudis asuva Flerovi tuumareaktsioonide labori (FLNR) ruumides.
Tähelepanuväärne on, et sõltumatult kinnitasid tulemusi ka Saksa teadlased Helmhotzi raskete ioonide uurimiskeskusest (GSI), mis asub Saksamaal Darmstadtis. 2009. aastal reageeris FLNRi teadlaste meeskond 70 päeva jooksul 48Ca koos aatomitega 249Bk, et saada elemendi 117 kuus aatomit. Seejärel õnnestus teadlastel 2012. aastal saada seitse elemendi 117 aatomit.
GSI sõltumatu kinnituse põhjuseks oli veel üks katse: teadlased üritasid toota elementi 119, mis avaks perioodilise tabeli kaheksanda perioodi. Sel juhul oli idee reageerida ioonile 50Sind sihtmärgiga 249bk. Kuid vaatamata jõupingutustele ei tuvastatud seda elementi pärast neli kuud kestnud katseid.
Titaaniioonide muutmine 48Ca, GSI teadlased otsisid haruldast, kuid teadaolevat ülirasket elementi, et kontrollida oma katseprotseduure. Nii sünteesisid nad lõpuks elemendi 117, mille abil kinnitas Iupac seda elementi.
THE Nimi tenesso viitab USA Tennessee osariigile.See oli viis mitte ainult austada mõnede FLNR-i katsetes osalenud teadlaste päritolu, vaid ka meenutada kohta, kus 249Bk, mis on avastuse jaoks ülioluline, sünteesiti Oak Ridge'i riiklikus laboris. Inglise keeles on elemendi nimi tennessine, mille järelliide kaasneb teiste halogeenidega: fluor, kloor, broom, jood, ja astatiin.
Lahendas harjutusi tenesol
küsimus 1
Tenesso, sümbol Ts, on halogeenide rühma (rühm 17) viimati lisatud element. Seetõttu eeldatakse, et perioodiliste omaduste põhjal on selle keemiline käitumine sarnane selle rühma elementide omaga. Seega saab järgmiste alternatiivide hulgast väita, et teneso:
A) on kuus valentselektroni.
B) on selle rühma elementide hulgas väikseima aatomiraadiusega.
C) on selle rühma elementide hulgas madalaim elektronegatiivsus.
D) vajab täisokteti saavutamiseks kolme elektroni.
E) omab rühma 17 suurimat elektronide afiinsust.
Resolutsioon:
Alternatiiv C
Ts-l on, nagu kõigil rühma 17 elementidel, seitse elektroni valentskiht, millel on valentskihina 7s kiht2 7p5. Seega võib järeldada, et oktetini jõudmiseks vajaks ta elektroni, kuna selle valentskihis on seitse elektroni.
Halogeenide seas suurima elektronkihtide arvuga elemendina on Ts ka kõige suurem aatomi raadius, mis garanteerib vähem elektronide afiinsus, kuna lisatud elektronid oleksid tuumast üsna kaugel. Väikseima raadiuse tõttu on Tennessol ka kõigist rühma 17 elementidest madalaim elektronegatiivsus.
küsimus 2
Teneso, sümbol Ts ja aatomnumber 117, tuvastati esmakordselt selle kahe isotoobi moodustumisega: mass 293 ja mass 294. Seega võib öelda, et neutronite arv 293Ts ja alates 294Ts on võrdne vastavalt:
A) 293 ja 294
B) 117 ja 118
C) 177 ja 294
D) 176 ja 177
E) 176 ja 293
Resolutsioon:
Alternatiiv D
Kahe isotoobi neutronite arvu saab määrata järgmiselt:
A = Z + n
A on arv pasta aatomiline, Z prootonite arv (aatomarv) ja n on neutronite arv.
Asendades isotoobi 293, on meil:
293 = 117 + n
n = 293-117
n = 176
Isotoobi 294 jaoks on meil:
294 = 117 + n
n = 294-117
n = 177
Autor Stefano Araújo Novais
Keemia õpetaja