Reaktsioonid lisamine on orgaanilise sünteesi seisukohalt olulised tegevused, sest nende kaudu saab välja töötada huvitava hulga orgaanilisi aineid.
Lisamisreaktsiooni toimumiseks on vaja süsinikuahelasse luua kaks sidumissaiti, mis tekib lihtsalt siis, kui ahel on küllastumata (olemasolu pi link). Seega, kui pi-lüli katkeb, ilmuvad saidid ahelasse.
Rühm aineid, mida saab kasutada lisaks sünteesile, on tsükloalkaanid või tsüklaanid, tsükliliste ja küllastunud ahelatega süsivesinike rühm. Nad pääsevad üldisest liitmise reeglist, kuna neil pole pi-linki, kuid need sõltuvad teatud tingimustest (kuumus, katalüsaatormetall, happeline keskkond) nad võivad läbida ahela katkemise kahe süsinikuaatomi vahel, põhjustades lisamise toimumiseks kahe seondumiskoha tekkimist. Siiski on tõsiasi, mis piirab nende ühendite kasutamist. Fakt on kõne ringstressi teooria, pakkus välja Adolf V. Bayer 1885. aastal.
Et süsinikuvaheline sigma side katkeks, peab süsiniku vahel olema teatav ebastabiilsus. See ebastabiilsus on seotud süsinikuvaheliste sidemete nurgaga. Bayeri sõnul on nurk, mis annab a
suur stabiilsus sigma lingi jaoks on 109,47O. Seega ahelad, mille süsinikuaatomitevaheline nurk on väiksem kui 109,47O neil on ahelaid moodustavate süsinikuaatomite vahelised sigma-sidemed ebastabiilsed, mis soodustab nende katkemist ideaalse välise seisundiga.Ainsad tsükloalkaanid, mille nurk on väiksem kui 109,47O selle süsiniku hulgas on tsüklopropaan (60O), tsüklobutaan (90O) ja tsüklopentaan (108O). Tsüklopentaani nurk on väga lähedal 109,47O sellel on väga stabiilsed sigma sidemed, seetõttu ei saa see läbida liitumisreaktsiooni. Allpool on nende kolme tsükloalkaani struktuurid:

Tsüklopropaani, tsüklobutaani ja tsüklopentaani struktuurivalem vastavalt
Vaatlus: Iga tsükloalkaan, mille ahelas on rohkem kui 5 süsinikku, viib läbi asendusreaktsiooni näide ja mitte kunagi lisa, sest nende süsinikuaatomite vahelised sigma sidemed on äärmiselt suured stabiilne.
Tsükloalkaanidega võivad toimuda kõik liitumisreaktsioonid, kuid tsüklopentaaniga võivad need toimuda ainult hüdrogeenimise ja halogeenimise teel. Allpool on näited tsükloalkaanide lisamisest ja nende esinemistingimustest:
a) Hüdrogeenimine
Tsükloalkaani reaktsioon vesiniku molekuliga pulbrilise metallkatalüsaatori (tsink, nikkel või plaatina) juuresolekul kuumutamisel (umbes 180 °C)OÇ). Selles reaktsioonis tekitab tsükloalkaan a alkaan. Selles reaktsioonis lisatakse pärast tsükli katkemist igale katkenud sigma sideme süsinikule üks vesinikuaatom.
Ära nüüd lõpeta... Peale reklaami on veel midagi ;)

Lisamisreaktsioon tsüklobutaanis, kasutades vesinikku
b) Halogeenimine
Tsükloalkaani reaktsioon halogeeni molekuliga (näiteks kloor, broom, jood) raud III kloriidi katalüsaatori (FeCl) juuresolekul3). Selles reaktsioonis tekitab tsükloalkaan a orgaaniline halogeniid mille ahelas on kaks halogeeniaatomit. Pärast tsükli katkemist lisame igale katkenud sigma sideme süsinikule halogeeniaatomi.

Lisamisreaktsioon tsüklobutaanis, kasutades broomi
c) Reaktsioon halogeenhüdriididega (happehalogeniididega)
Tsükloalkaani reaktsioon halogeeni sisaldava anorgaanilise hüdraadi molekuliga (HCl. HBr, HI). Kuna reagendina kasutatakse hapet, siis katalüsaatorit ei kasutata. Selles reaktsioonis tekitab tsükloalkaan a orgaaniline halogeniid mille ahelas on ainult üks halogeeniaatom. Pärast tsükli katkemist on meil ühele katkenud sigma sideme süsinikule lisatud vesinikuaatom ja teisele süsinikule halogeen. Järgides Markovnikovi reeglit (H kõige hüdrogeenitud süsinikul ja halogeen kõige vähem hüdrogeenitud süsinikul).
Märkus. See esineb ainult tsüklopropaani ja tsüklobutaani puhul.
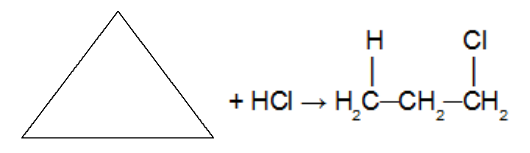
Lisamisreaktsioon tsüklopropaanis, kasutades vesinikkloriidhapet
Märkus. See esineb ainult tsüklopropaani ja tsüklobutaani puhul.
d) Niisutus
Tsükloalkaani reaktsioon veemolekuliga väävelhappe juuresolekul ja kuumutamine. Selles reaktsioonis tekitab tsükloalkaan a monoalkohol (alkohol, mille ahelas on ainult üks OH-rühm). Pärast tsükli katkemist on meil ühele katkenud sigma sideme süsinikule lisatud vesinikuaatom ja teisele süsinikule hüdroksüülrühm (OH). Järgides Markovnikovi reeglit (H kõige hüdrogeenitud süsinikul ja hüdroksüülrühm kõige vähem hüdrogeenitud süsinikul).
Märkus. See esineb ainult tsüklopropaani ja tsüklobutaani puhul.

Lisamisreaktsioon tsüklopropaanis, kasutades vesinikkloriidhapet
Mina. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Lisandused tsüklaanides"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/adicoes-ciclanos.htm. Sissepääs 27. juulil 2021.
Keemia

Hüdroksüüli funktsionaalrühm, primaarsed alkoholid, sekundaarsed alkoholid, tertsiaarsed alkoholid, metanool, glütserool, etanool, nitroglütseriini valmistamine, värvide valmistamine, alkohoolsete jookide tootmine, äädikhape, kütus autod.