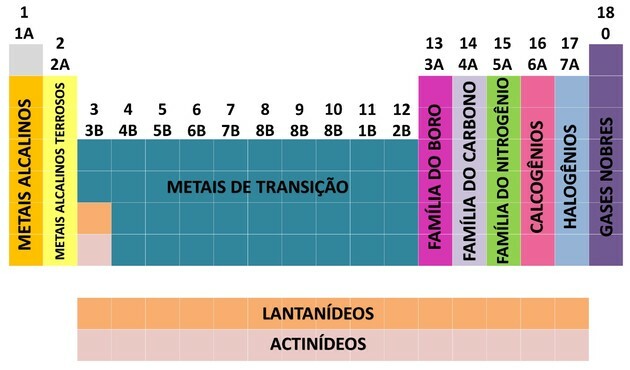
Keemiliste elementide üks korrastamise viise on perekondade kaudu, mis vastavad perioodilise tabeli vertikaalsetele järjestustele.
Kell 18 veergu Tabelis rühmitatakse elemendid vastavalt keemiliste omaduste sarnasustele.
Keemiliste elementide korrastamine perekondadeks oli praktiline viis leitud teabe struktureerimiseks ja nende lihtsaks esitamiseks.
Keemilise elemendi asukoha hõlbustamiseks määrati perekonnad numbritega 1–18 järgmiselt:
Paljude teadlaste panuse ja erinevate andmete korrastamise katsete kaudu arenes perioodilisustabel, luues korra elementide korrastamiseks.
Perede nomenklatuur
- Tabelis olevad perekonnad jaotati tähtedeks ja numbriteks tähtedeks A (tüüpiline) ja B (üleminek).
- Sina esinduslikud elemendid perekonnad 0, 1A, 2A, 3A, 4A, 5A, 6A ja 7A vastavad.
- Sina üleminekuelemendid perekonnad 1B, 2B, 3B, 4B, 5B, 6B, 7B ja 8B vastavad.
- Rahvusvahelise puhta ja rakendusliku keemia liidu (IUPAC) määramisel tuvastati perekonnad aastal rühmad 1-18.
Perioodiline tabel ja elektrooniline jaotamine
Sarnasused sama perekonna elementide vahel ilmnevad seetõttu, et aatomi valentselektronide arv põhiolekus on teatud rühma liikmete jaoks sama.
Näiteks:
| 1. rühm | Eletrooniline jaotus |
|---|---|
| 3lugeda | 2-1 |
| 11Kell | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
1. rühma aatomite elektronid on jaotunud rohkem kui ühele energiatasemele, kuid kõigil on valentselektron.
Sellega jälgime, et elektrooniline jaotus põhiolekus oleva aatomi, leiame selle positsiooni perioodilisustabelis.
esinduslikud elemendid
Tüüpilised elemendid omavad suhteliselt vähem keerukat keemilist käitumist kui siirdeelemendid ja moodustavad suurema osa ainetest meie ümber.
Mõnele esinduslike elementide perekonnale antakse spetsiaalsed nimed, nagu allpool näidatud:
Grupp |
Perekond | konkreetne nimi | Nime päritolu | Elemendid | elektrooniline konfiguratsioon |
|---|---|---|---|---|---|
| 1 | 1A | leelismetallid | ladina keelest leelis, mis tähendab "taimede halli". | Li, Na, K, Rb, Cs ja Fr | meile1 |
| 2 | 2A | leelismuldmetallid | Termin "maine" viitab "olemasolevale maa peal". | Ole, Mg, Ca, Sr, Ba ja Ra | meile2 |
| 13 | 3A | booriperekond | Perekonna esimese elemendi nimi. | B, Al, Ga, In, Tl ja Nh. | meile2np1 |
| 14 | 4A | süsiniku perekond | Perekonna esimese elemendi nimi. | C, Si, Ge, Sn, Pb ja Fl. | meile2np2 |
| 15 | 5A | Lämmastikuperekond | Perekonna esimese elemendi nimi. | N, P, As, Sb, Bi ja Mc. | meile2np3 |
| 16 | 6A | Kalkogeenid | kreeka keelest khalks, kuna need on elemendid, mida leidub vaskmaagides. | O, S, Se, Te, Po ja Lv. | meile2np4 |
| 17 | 7A | Halogeenid | Kreeka väljend, mis tähendab soolamoodustajaid. | F, Cl, Br, I, At ja Ts. | meile2np5 |
| 18 | 0 | Väärisgaasid | Leiti, et see ei reageeri teiste ainetega. | Tema, Ne, Ar, Kr, Xe, Re ja Og. | 1s2 (Tema) või meie2np6 |
Läbi tabeli näeme, et:
- Eespool toodud elemendid on klassifitseeritud representatiivseteks, kuna neil on kõige energilisem elektron s või p alamtasemel.
- Elektronid on jaotunud energiatasanditele ja n tähistab aatomi kõige kaugemat taset põhiolekus.
- Esinduselemendid kuuluvad vastavalt IUPACi soovitusele rühmadesse või perekondadesse 1,2,13,14,15,16,17 ja 18.
O vesinik see klassifitseeritakse teistest elementidest eraldi. Isegi 1s elektroonilise konfiguratsiooniga1, ei kuulu ta ainsuse käitumise esitamiseks 1. rühma.
üleminekuelemendid
Üleminekuelemendid vastavad rühmadele 3 kuni 12. Nad saavad selle nime, kuna neil on 1. ja 2. rühma ning mittemetalsete elementide vahelised omadused.
Sina siirdemetallid on IUPAC määratletud järgmiselt:
Üleminekuelemil on mittetäielik d alamtase või see võib moodustada katse mittetäieliku d alatasemega.
Kui põhiseisundi aatomi kõige energilisem elektron on mittetäielikus d alatasemes, iseloomustatakse seda kui välist üleminekut.
Lantaniidid ja aktiniidid on sisemised üleminekuelemendid, kuna neil on vähemalt üks mittetäielik f alamtase.
Kui elementidel on elektronid, mis täidavad d- või f-orbitaale, on neil sarnased omadused ja neid saab liigitada d- või f-orbitaalelementideks. välimine või sisemine üleminek.
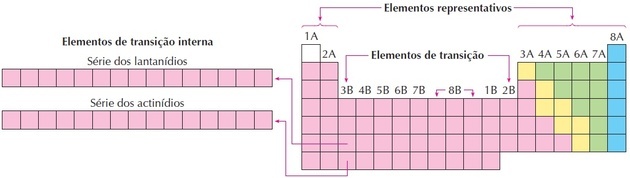
Nagu näeme pildil, vastab perekond 8B kolmele veerule, need on rühmad 8, 9 ja 10, mis rühmitati niimoodi, kuna neil on sarnased omadused.
Perekondade peamised omadused
Allolevas tabelis on toodud perioodilisustabeli rühmade peamised omadused:
| Grupp | Funktsioonid | liitained tavalisem |
esinemised |
|---|---|---|---|
| 1 | Tahke ja läikiv keskkonnatingimustes. Väga reaktiivsed, pehmed ja head elektrijuhid. | Soolad, hüdroksiidid ja oksiidid |
Reaktsioon halogeenidega ja moodustavad soolad. |
| 2 | Vähem reageeriv ja raskem kui 1. rühm. Hea juhtivusega hõbedased tahked ained. | Soolad, hüdroksiidid ja oksiidid |
Soolade ja oksiidide moodustamine. |
| 3 kuni 12 | Nad moodustavad komplekse. Need on metallilised tahked ained, kõvad ja rabedad, välja arvatud elavhõbe, mis on vedelik. | Soolad, oksiidid ja kompleksid. Nt: AgNO3, TiO ja [Cr (OH)3(H2O)3] |
Mineraalides oksiidide kujul. |
| 13 | Tahkised keskkonnatingimustes, hõbe, välja arvatud boor. | Oksiidid Nt: B2O3 |
Mineraalides oksiidide kujul. |
| 14 | Tahkes keskkonnatingimustes. | C- ja Si-aatomid võivad paigutada end ahelatesse ja toota tohutult erinevaid aineid. | Elusorganismides ja silikaatide või oksiidide kujul. |
| 15 | Tahked ained, välja arvatud lämmastik, mis on keskkonnatingimustes gaasiline. | Oksiidid ja happed Nt: EI2 ja H3TOLM4 |
Atmosfäär, elusorganismid ja mineraalid. |
| 16 | Tahked ained, välja arvatud hapnik, mis on keskkonnatingimustes gaasiline. | Sulfiidid ja oksiidid Nt: ZnS ja SiO2 |
Atmosfäär, elusorganismid ja mineraalid. |
| 17 | Nad moodustavad diatoomsed molekulid ja on väga reaktsioonivõimelised. Nad on halvad elektri- ja soojusjuhid. Nad on elusolendite ja keskkonna suhtes agressiivsed. | Happed ja soolad. Nt: HCl ja KBr |
On ainetes orgaaniline ja mineraalne. |
| 18 | Need on väga stabiilsed ja neid leidub gaaside kujul. | Nad ei moodusta vaevalt liitühendeid. | Gaasid atmosfääris. |
Keemilised ja füüsikalised omadused eristavad ühte perekonda teisest. Nagu nägime, on keemilised omadused seotud elektronid valentsja nende kaudu suhtleb aatom teisega, vastutades keemilise käitumise ja keemilised sidemed moodustatud.
Sama rühma elementide füüsikalised omadused võivad varieeruda vastavalt aatomite arvule ja massile.
Harjutused
Nüüd, kui olete Perioodilise tabeli peredest veidi rohkem teadnud, proovige oma teadmisi ja vaadake, mida olete õppinud.
1) Mõelge järgmisele perioodilise tabeli väljavõttele.
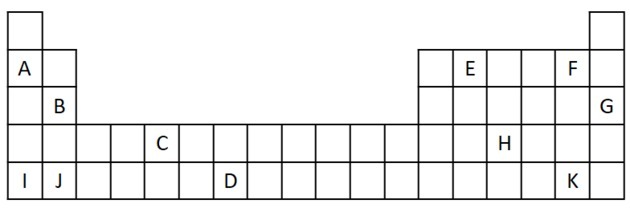
a) Nimeta kaks elementi, millel on kaks valentselektroni.
b) Märkige element, mis veega reageerib ägedalt, saades metallhüdroksiidi.
c) märkige mittereaktiivne element.
d) Märkige kaks elementi, mis koos leelismetallidega moodustavad soolad.
Vastus:
a) B ja J
Kaks valentselektroni vastavad rühmale 2, millel on ns elektronkonfiguratsioon2 ning neid esindavad õppusel B ja J.
b) A, B, I või J.
A ja I esindavad perekonna 1 elemente; B ja J on perekonnast 2. Nagu nägime omaduste tabelist, on rühma 1 ja 2 elemendid väga reageerivad ja võivad moodustada hüdroksiide, nagu toodud näidetes: KOH ja Mg (OH)2.
c) G
Väärisgaasid on väga stabiilsed ja seetõttu mitte eriti reaktiivsed. Selle perekonna elemendina lisatakse tabelisse G-täht.
d) F ja K
Halogeenid reageerivad leelismetallidega soolade moodustamiseks. Selle kõige levinum näide on lauasool NaCl.
2) Järgmine joonis näitab kolme keemilist elementi vasakult paremale, liitium, naatrium ja kaalium.

Valige suvand, mis täidab kõik järgmised väited õigesti.
1.1) "Võime öelda, et liitium, naatrium ja kaalium ...
(A)… kuuluvad samasse perioodi. "
(B)… on sama aatomnumbriga. "
(C)… kuuluvad samasse rühma. "
(D)… on sama massinumbriga. "
1.2) "elemendid liitium, naatrium ja kaalium ...
(A)… on väga sarnaste keemiliste omadustega. "
(B)… sellel on väga erinevad keemilised omadused. "
(C)… on mittemetallid. "
(D)… reageerivad veega, moodustades happelised lahused. "
Vastused:
1.1) (C) kuuluvad samasse rühma.
1.2) (A) keemiliste omadustega on väga sarnased.
Selle teabe saame perioodilisustabeli abil või elementide liitium-, naatrium- ja kaaliumielektroonilise levitamise teel. Näeme, et nende kolme valentskoores on elektron ja kuna nad kuuluvad samasse rühma, on keemilised omadused väga sarnased.
3) Vaatleme järgmist tabelit, kus on kujutatud mõnede keemiliste elementide aatomnumbrid ja elektroonilised jaotused.
| Element | keemiline sümbol | aatomnumber | Eletrooniline jaotus |
|---|---|---|---|
| Liitium | lugeda | 3 | 2,1 |
| Berüllium | olema | 4 | 2,2 |
| Fluor | F | 9 | 2,7 |
| neoon | Ah | 10 | 2,8 |
| kloor | Cl | 17 | 2,8,7 |
| argoon | Õhk | 18 | 2,8,8 |
| Kaalium | K | 19 | 2,8,8,1 |
| Kaltsium | Siin | 20 | 2,8,8,2 |
Märkige iga elemendi rühm.
Vastus:
Liitium ja kaalium: 1. rühm. (Neil on valentskoores elektron).
Berüllium ja kaltsium: 2. rühm. (Neil on valentskoores kaks elektroni).
Fluor ja kloor: rühm 17. (Neil on valentskoores seitse elektroni).
Neoon ja argoon: rühm 18. (Neil on valentskoores kaheksa elektroni).
Vaadake sisseastumiseksami küsimusi kommenteeritud resolutsiooniga aastal Harjutused perioodilisustabelis aastal avaldamata vastavaid küsimusi Harjutused perioodilise tabeli korraldamiseks.


