Molekulidevaheliste jõudude hulgas on indutseeritud dipool-indutseeritud dipooljõud need on ainsad, mida Hollandi füüsik Johannes Diederik Van der Waals (1837-1923) ei uurinud. Neid selgitas välja saksa füüsik Fritz Wolfgang London (1900-1954), mistõttu neid jõude nimetatakse ka nn. londoni väed või Londoni hajutusjõud. Teine nendele jõududele antud nimi on hetkeline dipool-indutseeritud dipool.
Selline jõud ilmneb mittepolaarsed ainednäiteks H2, O2, F2, Cl2, CO2, CH4 ja C2H6. Ja need võivad tekkida ka vahepeal väärisgaasi aatomid, kui nad lähenevad, põhjustades nende elektrosfääride vahel tõrjumist. Nii akumuleeruvad elektronid negatiivse laengu defitsiidi tõttu teatud poolele, mis on negatiivselt polariseeritud ja vastaspoolele positiivselt.
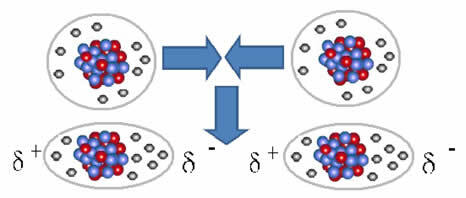
Mittepolaarsed molekulid võivad minna gaasilisest olekust – kus nad on teineteisest väga kaugel ja puudub interaktsioon, kuna poolused puuduvad – vedelasse ja tahkesse olekusse. Nendes agregatsiooniseisundites on molekulid lähemal ning nende elektronide ja elektronide vahel tekivad elektroonilised külgetõmbed või tõukejõud. tuumad võivad põhjustada nende elektrooniliste pilvede hetkelise deformatsiooni, millest tulenevad positiivsed ja negatiivsed poolused ajutine.
Hetkelised dipoolid võivad indutseerida naabermolekulide polarisatsiooni, mille tulemuseks on atraktiivsed jõud.
Ära nüüd lõpeta... Peale reklaami on veel midagi ;)
See induktsioon võib samuti tekkida. erinevate molekulide vahel ja üldiselt need jõud on nõrgema intensiivsusega kui dipool-dipool ja vesiniksideme tugevused. Seetõttu on sellise vastastikmõju tugevusega tahked ained, nagu kuivjää (süsinikdioksiid - CO2) ja jood (I2), mis on tahkes olekus, ülevad (lähevad gaasilisse olekusse); sest nende vastasmõju katkestamiseks vajalik energia on väike.
Näide molekulidevahelistest jõududest polaarsete ja mittepolaarsete molekulide vahel esineb gaasilise (mittepolaarse) ja vee (polaarse) vahel. Selgub, et vee negatiivne ots läheneb O2-le, tõrjudes ennast ja seega eemaldub mittepolaarse molekuli elektrooniline pilv. Seejärel hapnik hetkeks polariseerub ja hakkab veega suhtlema, lahustudes selles.
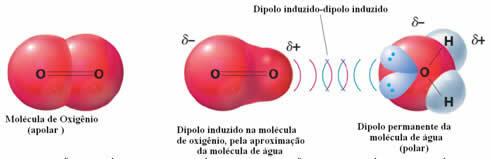
Kuna need jõud on nõrgad, on selle gaasi lahustuvus vees väike. Sellegipoolest on selle olemasolu erinevate veeorganismide elu säilitamiseks hädavajalik.
See koostoimejõud esineb ka looduses, tagades kleepumise gekode käppade ja pinna vahel, millel nad kõnnivad. Seetõttu saavad nad kõndida seintel ja lagedel, kukkumata või kinni kleepuma.
Autor Jennifer Fogaça
Lõpetanud keemia eriala
Brasiilia koolimeeskond
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "indutseeritud dipool-induced dipool või London dispersioonjõud"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/forcas-dipolo-induzido-dipolo-induzido-ou-dispersao-london.htm. Sissepääs 27. juulil 2021.


