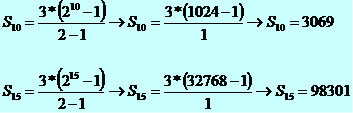THE entalpia on termodünaamiline funktsioon, mille abil arvutab isobaarsetes protsessides osaleva soojusest mida hoitakse pideva rõhu all. Selle väljatöötamine toimus vahetult pärast kaloriteooria langust, edenedes termodünaamika aastatel 1840–1850.
Entalpia jaoks midaumica, ei oma erilist tähendust, kui seda kasutatakse absoluutse ja isoleeritud väärtusena, kuid see on siiski oluline selle väärtuse muutumine keemilises protsessis. Protsessi entalpia variatsiooni arvutamiseks on mitu võimalust, millest peamised on moodustumise, sidumisenergia ja ka sealtere hessist.
Loe ka: Mis on Gibbsi vaba energia?
Entalpia kokkuvõte
Entalpia on termodünaamiline tööriist konstantsel rõhul toimuvates protsessides osaleva soojuse arvutamiseks.
Selle defineeris Ameerika füüsik Josiah W. Gibbs, kaloriteooria languse kontekstis.
Keemias kasutame alati entalpia muutust, mis on esitatud kui ΔH.
Soojust neelavaid keemilisi reaktsioone nimetatakse endotermilisteks ja nende ΔH > 0.
Soojust eraldavaid keemilisi reaktsioone nimetatakse eksotermilisteks ja nende ΔH < 0.
Videotund entalpiast
Mis on entalpia?
Entalpia, mida alati tähistab H, oli algselt defineeris Ameerika füüsik Josiah Willard Gibbs, mida ta nimetas kuumuse funktsiooniks konstantsel rõhul, kuna tema sõnadega:
"[…] funktsiooni vähenemine on kõigil juhtudel, kui rõhk ei muutu, süsteemi poolt eraldatud soojust."
Gibbsi töö põhjal saame entalpiat mõista kui termodünaamilist funktsiooni, mille variatsioon on arvuliselt võrdne süsteemis vahetatava soojushulgaga survet konstantne. See tähendab, et isobaarilistes protsessides (nagu enamik keemilisi protsesse) teadmine arvutada entalpiafunktsiooni varieeruvus, siis saab teada süsteemi ja vahel vahetatava soojuse väärtuse naabruskond.

Selline korrelatsioon soojusega põhjustab paljud õpilased arvavad ekslikult, et entalpia on sünonüüm soojust või midagi sellist nagu energiasisaldus, soojussisaldus, eraldunud soojus ja neeldunud soojus jms.
Entalpia tekkis kaloriteooria kokkuvarisemise kontekstis, mis käsitles soojust kui hindamatut materiaalset ainet, mis kandus soojematest kehadest külmematesse kehadesse. Seega tekkis vajadus uue vahendi järele soojuse arvutamiseks. Lahenduseks oli siis kasutada suurusi, millel olid juba määratletud termodünaamilised võrrandid, näiteks entalpia.
Loe ka: Kuidas arvutada lahuse entalpia muutust?
entalpia variatsioon
Kuna entalpia on vahend, mida kasutatakse keemilises protsessis vahetatava soojuse arvutamiseks, ei ole mõtet seda kasutada absoluutarvuna, kuid arvestades selle varieerumist, st praktikas, peaksime hindama vaid seda, kui palju arvuliselt entalpia keemilise protsessi käigus muutus, kuna termodünaamika kinnitab meile, et tema variatsioon on arvuliselt võrdne protsessi käigus vabanenud või neeldunud soojusega.
Rangelt võttes saame entalpia variatsiooni määratleda järgmiselt:
ΔH = HLõplik - Hesialgne
Nagu keemiliste protsesside puhul, võib viimaseks etapiks pidada tooteid ja esialgseks etapiks reaktiive. Samuti on tavaline, et entalpia variatsiooni määratlus on järgmine:
ΔH = Htooted - Hreaktiivid
Praktilisest ja tõlgenduslikust vaatenurgast kui entalpia muutus on positiivne (ΔH> 0), me ütleme, et keemiline reaktsioon on endotermilinest kogu protsessi vältel toimub soojuse neeldumine. juba kui entalpia muutus on negatiivne (ΔH< 0), me ütleme, et keemiline reaktsioon on eksotermilinest soojust eraldub kogu protsessi vältel.
Entalpia varieerumist on paljudel juhtudel täheldatud graafikutel, nagu on näidatud järgmistes näidetes.
Näide 1:
Endotermilise reaktsiooni diagramm
Endotermiliste reaktsioonide entalpiagraafikutel on näha, et produktide entalpia hulk on suurem kui reaktiivide oma, mis näitab, et varieeruvus reaktsioonis on positiivne. Seega, kui ΔH > 0, võime öelda, et keemiline protsess toimus soojuse neeldumisega.

Näide 2:
Eksotermilise reaktsiooni diagramm:
Eksotermiliste reaktsioonide entalpiagraafikutel on näha, et produktide entalpia hulk on väiksem kui reagentidel, mis näitab, et kõikumine reaktsioonis on negatiivne. Seega, olles ΔH < 0, võime öelda, et keemiline protsess toimus soojuse vabanemisega.

Lisateavet nende keemiliste reaktsioonide klassifikatsioonide kohta leiate tekstist: FORendotermilised ja eksotermilised protsessid.
Entalpia tüübid
moodustumise entalpia
THE moodustumise entalpia é arvutatud põhinedes keemiliste reaktsioonide moodustumine, mis on reaktsioonid, mille käigus moodustub üks mool liitaineid nende kõige stabiilsematest lihtainetest toatemperatuuril ja 1 atmosfääri rõhul.
H2(g) + ½ O2 (g) → H2O (l) H°f = -286 kJ/mol
Tekkimisentalpia suur eelis seisneb selles, et lihtsate ainete, mis on toatemperatuuril ja 1 atmosfääri rõhul stabiilsemad, entalpia on kokku lepitud nulliga. See ei tähenda, et need on tegelikult nullid, kuid lihtsustamise ja parema klassifitseerimise huvides koheldakse neid nii.
Olemine H = Htooted - Hreaktiivid, kui arvestada, siis Hreaktiivid = 0, võime öelda, et vaadeldud ΔH väärtus on seotud ainult toodetega, mis nendel juhtudel on alati üks mool liitainet. Seetõttu esitame selle väärtuse vee moodustumise standardse entalpia variatsioonina, mida tähistab ΔH °f.
Just selle metoodikaga oli mitmetel ainetel oma variatsioonid standard entalpia moodustamise tabelid, nagu näeme allpool.
Aine |
Moodustumise entalpia (ΔH°f) kJ/mol |
CO2 (g) |
-393,4 |
CaO(d) |
-634,9 |
HI(g) |
+25,9 |
EI (g) |
+90,1 |
siduva entalpia
Sidumisentalpia näitab energia hulka, mis on seotud antud mooli purunemise või moodustumisega. keemiline side.
On arusaadav, keemilise sideme purustamiseks on vaja soojust neelata, nii et siduvad aatomid suurendavad oma sisemine energia ja sellest tulenevalt suurendada oma kineetilist energiat. suuremaga kineetiline energia, aatomid vibreerivad intensiivsemalt, põhjustades sidemete katkemise. Seega on iga sideme katkemine endotermiline protsess.
Vastasel juhul kaotavad aatomid keemilise sideme moodustamiseks liikumisvabaduse ja peavad oma liikumisastet vähendama, vähendades nende kineetilist energiat. Seejärel vabaneb varuenergia soojuse kujul. Seega kogu sidemete moodustumine on eksotermiline protsess.
Allolev tabel näitab iga keemilise sidemega seotud energiate väärtusi.
Ühendus |
Sidumisenergia (kJ/mol) |
C-H |
412,9 |
C-C |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
EI |
943,8 |
Pange tähele, et väärtustes pole märke, kuna need on moodulis. Seda seetõttu, et signaali peate määrama teie sõltuvalt sellest, kas link on katkenud või moodustunud.
Põlemise entalpia
THE põlemise entalpia tähistab soojushulk, mis vabaneb ühe mooli aine põlemisel. Tuleb märkida, et iga põlemisreaktsioon on eksotermiline, kuna iga põlemine eraldab soojust.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2ΔH°Ç = -889,5 kJ/mol
Allolev tabel näitab mõnede keemiliste ainete põlemisentalpia väärtusi.
Aine |
Põlemise entalpia (ΔH°Ç) kJ/mol |
Etanool - C2H5OH (1) |
-1368 |
Benseen - C6H6 (1) |
-3268 |
Oktaanarv - C8H18 (1) |
-5471 |
Glükoos - C6H12O6 (s) |
-2808 |
Füüsikalise seisundi muutumise entalpia
Iga füüsilise seisundi muutus hõlmab soojusvahetust. Seetõttu on füüsilise seisundi muutumise entalpia tähistab füüsikalise oleku muutumise protsessides osalev soojushulk.
Näiteks on meil vee aurustamine:
H2O (1) → H2O (g) ΔH = +44 kJ/mol
Vee sulamisel on meil:
H2O(d) → H2O (l) ΔH = +7,3 kJ/mol
Entalpia väärtused on pöördprotsesside jaoks sümmeetrilised, mis tähendab, et näiteks vee veeldamisel on entalpia muutus -44 kJ/mol, selle tahkumisel aga -7,3 kJ/mol.
Loe ka: Mis on entroopia?
Lahendas entalpia harjutusi
Küsimus 1 - (UERJ 2018) Kütusena kasutatava süsivesiniku saastevõime määrab eralduva energia ja CO koguse suhe2 moodustub selle täielikul põlemisel. Mida suurem suhe, seda väiksem on saastevõime. Allolev tabel näitab nelja süsivesiniku standardset põlemisentalpiat.

Tabelist on madalaima saastevõimega süsivesinik:
oktaanarv
Heksaan
Benseen
pentaan
Resolutsioon
Alternatiiv D
Küsimus näitab, et saastevõimet defineeritakse kui suhet (jagatist) vabaneva energia ja CO koguse vahel.2 moodustub selle täielikul põlemisel. Mida suurem on põhjus, seda väiksem on saastevõime, st rohkem energiat vabaneb CO mooli kohta2 loodud.
Täielikud põlemisreaktsioonid Süsivesinikud viidatud on:
oktaanarv: Ç8H18 +25/2 O2 → 8 CO2 + 9 tundi2Põhjus: 5440/8 = 680
Heksaan: Ç6H14 +19/2 O2 → 6 CO2 + 7 tundi2Põhjus: 4140/6 = 690
Benseen: Ç6H6 + 15/2 O2 → 6 CO2 + 3 H2Põhjus: 3270/6 = 545
pentaan: Ç5H12 + 8 O2 → 5 CO2 + 6 H2Põhjus: 3510/5 = 702
Seega võime järeldada, et pentaan on väikseima saastevõimega süsivesinik.
2. küsimus – (Enem 2015) Metsajääkide kasutamine muutub iga päevaga atraktiivsemaks, kuna tegemist on taastuva energiaallikaga. Joonisel on kujutatud puidujäätmetest ekstraheeritud bioõli põletamine, kus ΔH1 entalpia kõikumine 1 g selle bioõli põletamisel, mille tulemuseks on süsinikdioksiid ja vedel vesi ning ΔH2 entalpia muutus, mis on seotud 1 g gaasilise vee muutumisega vedelaks.

Entalpia variatsioon kJ-des 5 g selle bioõli põletamisel, mille tulemuseks on CO2 (gaasiline) ja H2(gaasiline) on:
A) -106
B) -94
C) -82
D) -21,2
E) -16,4
Resolutsioon
Alternatiiv C
Näidatud graafikult on meil ΔH1 kui bioõli põletamise entalpia variatsioon, mis toodab CO2 (g) ja H2O (1) ja ΔH2 vee veeldamise entalpia muutusena, kuna CO2 jääb gaasiliseks ja ainult füüsikaline olek Vesi muutused (gaasist vedelaks).
Harjutus nõuab 5 g bioõli põletamise entalpia muutust, mille tulemuseks on CO2 (gaasiline) ja H2O (gaasiline). Diagrammil saab selle entalpia muutuse defineerida kui ΔH = ΔH1 – H2. Seega on ΔH väärtus -16,4 kJ/g. See variatsioon, nagu me ühikust näeme, on IGA grammi bioõli jaoks. 5 grammi puhul peame tegema proportsioon:
1 g bioõli -16,4 kJ
5 g bioõli x
1. x = 5. (-16,4)
x = -82 kJ
Seejärel saame märkida alternatiivi C.
Autor: Stéfano Araújo Novais
Keemia õpetaja