O kuumus on soojusenergia kahe keha vahel läbisõidul, motiveeritud erinevusest temperatuur. See energia voolab alati kõrgeima temperatuuriga kehast madalaima temperatuuriga kehasse ja selle vool lakkab alles siis, kui osalevate kehade temperatuur muutub võrdseks.
Soojuse tüübid
Soojusallikaga kokkupuutel võib iga materjal muuta temperatuuri või temperatuuri. liitmise füüsiline olek molekulidest.
kuumus on öeldud tundlik kui see on võimeline muutma ainult keha temperatuuri. kuumus on öeldud varjatud kui see muudab temperatuuri ja tekitab muutuse aine molekulide agregatsiooni olekus.
Varjatud kuumuse arvutamine
summa varjatud kuumus see määratakse olekumuundumise läbinud keha massi (m) ja nn varjatud sulamis- või aurumissoojuse (L) korrutise järgi.
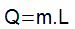
Soojuse hulka, mis on vajalik iga grammi aine oleku muutmiseks, nimetatakse varjatud auruks või sulandumiseks. Näiteks vee puhul on varjatud aurustumissoojus 540 cal / g, st iga gramm 100 ° C juures vajav vesi vajab vedelas olekus muutumiseks 540 cal soojust gaasiline.
Näited
1. näide (Uerj) - Allpool olev graafik näitab 10 g aine termilist käitumist, mis allikast soojust vastu võttes läheb tahkest faasist täielikult vedelasse faasi.

Selle aine varjatud sulamissoojus (kal / g) on võrdne järgmisega:
a) 70
b) 80
c) 90
d) 100
Vastus: A-täht
Graafiku horisontaalne osa tähistab füüsikalise oleku muutust, mille korral soojus lakkab toimimast temperatuurimuutustes ja hakkab toimima viisil, mis muudab elemendi liitmisolekut. Selles graafiku osas oli kaasatud soojushulk 700 cal (1000 - 300 = 700 cal).
Varjatud termotuumasünteesi saab määrata varjatud kuumuse võrrandi põhjal:
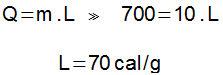
2. näide - 2000 g vee mass on täpselt 100 ° C juures. Teades, et vee aurustumissoojus on 540 cal / g, määrake 30% vee massist aurutamiseks vajalik soojushulk kcal.
a) 224
b) 250
c) 300
d) 360
e) 324
Vastus: E-täht
Arvestatav vee mass on 600 g, mis vastab 30% -le kogu veest. Seega on aurustamiseks vajalik soojushulk:

Autor Joab Silas
Lõpetanud füüsika
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-calor-latente.htm

