Keemiline isomeeria on nähtus, mida täheldatakse, kui kahel või enamal orgaanilisel ainel on sama molekulivalem, kuid erinev molekulaarne struktuur ja omadused.
Nende omadustega keemilisi aineid nimetatakse isomeerideks.
Mõiste on tuletatud kreekakeelsetest sõnadest iso = võrdsed ja lihtsalt = osad ehk võrdsed osad.
Isomeeriat on erinevat tüüpi:
- lame isomeer: Ühendid identifitseeritakse lamedate struktuurivalemitega. See jaguneb ahela isomeeriks, funktsiooni isomeeriks, positsiooni isomeeriks, kompensatsiooni isomeeriks ja tautomeeria isomeeriks.
- kosmose isomeer: Ühendite molekulaarsel struktuuril on erinev ruumiline struktuur. See jaguneb geomeetriliseks ja optiliseks isomeeriks.
lame isomeer
Kell lame isomeeria ehk põhiseaduslik isomeeria, orgaaniliste ainete molekulaarne struktuur on lame.
Seda omadust omavaid ühendeid nimetatakse lamedateks isomeerideks.
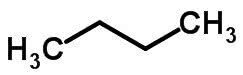
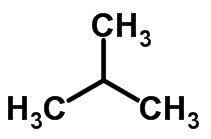
ahela isomeer
Ahela isomeeria toimub siis, kui süsinikuaatomitel on erinevad ahelad ja sama keemiline funktsioon.
Näited:
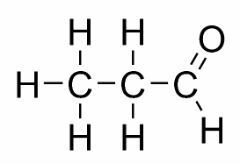
Funktsioon isomeeria
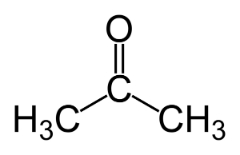
Funktsiooni isomeeria tekib siis, kui kahel või enamal ühendil on erinevad keemilised funktsioonid ja sama molekulivalem.
Näited: see juhtum on levinud aldehüüdide ja ketoonide vahel.
Asendi isomeer
Positsiooni isomeeria tekib siis, kui ühendeid eristatakse süsinikuahela erinevate küllastumata, hargnevate või funktsionaalsete rühmade asendite abil. Sel juhul on isomeeridel sama keemiline funktsioon.
Näited:

isomeeri tasaarvestamine
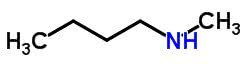
Kompenseeriv isomeeria või metamerism esineb sama keemilise funktsiooniga ühendites, mis erinevad heteroaatomite positsiooni poolest.
Näited:

Tautomeeria
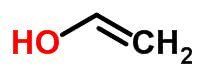
Tautomerismi või dünaamilist isomerismi võib pidada funktsiooni isomerismi konkreetseks juhtumiks. Sellisel juhul võib üks isomeer muutuda teiseks, muutes elemendi positsiooni ahelas.
Näited:

kosmose isomeer
THE kosmoseisomeeria, mida nimetatakse ka stereoisomeeriaks, juhtub siis, kui kahel ühendil on sama molekulvalem ja erinevad struktuurivalemid.
Seda tüüpi isomeerias jaotuvad aatomid samamoodi, kuid hõivavad ruumis erinevaid positsioone.
geomeetriline isomeer
THE geomeetriline isomeeria või cis-trans esineb küllastumata avatud ahelates ja ka tsüklilistes ühendites. Selleks peavad süsiniku ligandid olema erinevad.

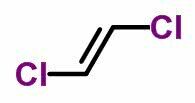
- Kui samad ligandid asuvad samal küljel, saab isomeeri nomenklatuur eesliite cis.
- Kui samad ligandid asuvad vastaskülgedel, saab nomenklatuur eesliite tõlk.
IUPAC (rahvusvaheline puhta ja rakendusliku keemia liit) soovitab cis ja trans asemel kasutada eesliidetena tähti Z ja E.
Seda seetõttu, et Z on saksakeelse sõna esimene täht zusammen, mis tähendab "koos". Ja see on saksakeelse sõna esimene täht entegegen, mis tähendab "vastupidist".
optiline isomeer
THE optiline isomeeria demonstreerivad optiliselt aktiivsed ühendid. See juhtub siis, kui aine on põhjustatud nurkhälbest polariseeritud valguse tasapinnas.
- Kui aine painutab optilist valgust paremale, nimetatakse seda paremakäeline.
- Kui aine painutab optilist valgust vasakule, nimetatakse ainet levorotary.
Aine võib eksisteerida ka kahes optiliselt aktiivses vormis, dekstogra ja levogüüra. Sellisel juhul nimetatakse seda enantiomeer.
Et süsinikuühend oleks optiliselt aktiivne, peab see olema kiraalne. See tähendab, et nende ligandid ei saa kattuda, olles asümmeetrilised.
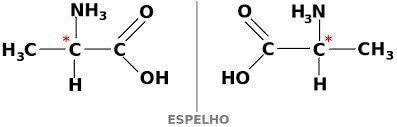
Omakorda, kui ühendil on dekstrogüüra ja levorotoorsed vormid võrdsetes osades, siis neid nimetatakse ratseemilised segud. Ratseemiliste segude optiline aktiivsus on passiivne.
Loe ka:
- Süsinik
- Orgaaniline keemia
- Molekulaarne valem
- struktuurivalem
Harjutused
1. (Mackenzie 2012) Numbriveerg B, mis sisaldab orgaanilisi ühendeid, seostades need veeruga A vastavalt isomeeriatüübile, mida iga orgaaniline molekul esitab.
Veerg A
1. isomeeri tasaarvestamine
2. geomeetriline isomeer
3. ahela isomeer
4. optiline isomeer
Veerg B
() tsüklopropaan
() etoksüetaan
() bromo-kloro-fluoro-metaan
() 1,2-dikloro-eteen
B-veeru õige arvude järjestus ülevalt alla on
a) 2 - 1 - 4 - 3.
b) 3 - 1 - 4 - 2.
c) 1 - 2 - 3 - 4.
d) 3 - 4 - 1 - 2.
e) 4 - 1 - 3 - 2.
Alternatiiv b) 3 - 1 - 4 - 2.
2. (Uerj) Isomeeria on nähtus, mida iseloomustab asjaolu, et sama molekulaarne valem esindab erinevaid struktuure.
Arvestades molekulaarvalemi C lamedat struktuurilist isomeeriat4H8, saame tuvastada järgmist tüüpi isomeere:
a) kett ja asend
b) ahel ja funktsioon
c) funktsioon ja kompenseerimine
d) positsioon ja hüvitis
Alternatiiv a) string ja asukoht
3. Propanoon ja isopropenool on näiteks isomeeria juhtum:
a) metameeria
b) funktsioon
c) tautomeeria
d) cis-tran
e) kett
Tautomeeria alternatiiv c)
Vaadake ka: Harjutused lameda isomeeria kohta