Aatom on aine põhiühik ja väikseim fraktsioon, mis on võimeline keemilist elementi identifitseerima, kuna sellel on oma identiteet. Termin aatom tuleneb kreeka keelest ja tähendab jagamatut.
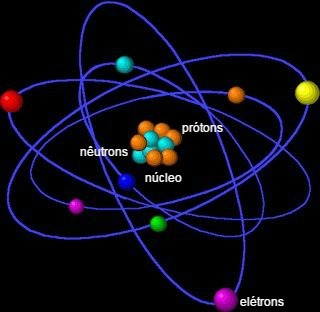
See koosneb tuumast, mis sisaldab neutrone ja prootoneid, ning tuuma ümbritsevatest elektronidest.
aatomi struktuur
Aatomi moodustavad väikesed osakesed, mida nimetatakse ka subatoomilised osakeseds: elektronid, prootonid ja neutronid.
Suurem osa aatomi massist on koondunud tuumasse, väikesesse tihedasse piirkonda. Selle suurim maht on elektrosfääris, tühjade ruumide kohas, kui elektronid tiirlevad ümber tuuma.
elektronid
O elektron sellel on negatiivne elektrilaeng (-1) ja mass peaaegu puudub, kuna selle väärtus on 9,11 x 10-28 g ja on umbes 1840 korda väiksem kui südamiku mass. Need on pisikesed osakesed, mis pöörlevad aatomituuma ümber väga kiiresti.
Elektronid, mis asuvad aatomi äärepoolseimates piirkondades, vastutavad keemiliste sidemete moodustumise eest, mis tekivad elektronide annetamise, vastuvõtmise või jagamise kaudu.
prootonid
O prooton selle positiivne elektrilaeng (+1) on sama absoluutväärtusega kui elektronide laeng. Sel moel kipuvad prooton ja elektron üksteist elektriliselt tõmbama.
Prootonite kaudu on võimalik eristada keemilisi elemente, sest iga elemendi aatomi tuumas on määratletud arv prootoneid, mida nimetatakse aatomnumber.
neutronid
O neutron sellel pole üldse laengut, see tähendab, et see on elektriliselt neutraalne. Koos prootonitega moodustab see aatomituuma, mis kannab kogu aatomi massi (99,9%). Nii prootoni kui ka neutroni mass on ligikaudu 1,67 x 10-24 g. See väärtus tähistab 1 μ aatomi massiühikut.
Neutron tagab aatomituuma stabiilsuse, kuna tuumajõud tõmbab teda elektronide ja prootonite poole.
Ainult vesiniku aatomil ei ole neutroneid, see koosneb lihtsalt elektronist, mis pöörleb prootoni ümber.
Kontrollige allolevast tabelist a abstraktne teabega subatoomiliste osakeste kohta.
| Osake | Sümbol |
Pasta (ühikus aatomimass) |
Laadige (ühikus elektrilaeng - u.c.e) |
Asukoht |
|---|---|---|---|---|
| Prooton | +1 | tuum | ||
| Neutron | 0 | tuum | ||
| Elektron | -1 | elektrosfäär |
Põhiajas olev aatom on elektriliselt neutraalne, kuna prootonite arv on võrdne elektronide arvuga ning vastupidised positiivsed ja negatiivsed laengud tühistavad üksteise.
Näiteks on naatriumil (Na) aatomnumber 11, see tähendab, et selle tuumas on 11 prootonit. Järelikult on selle elemendi aatomi elektrosfääris 11 elektroni.
Loe lähemalt aatomi struktuur.
aatomi koostis
Nagu nägime, moodustab aatomi väike ja tihe keskpiirkond, mida nimetatakse tuumaks ja selle ümber on a elektrosfäär, kus asuvad elektronid, mida saab jagada elektroonilisteks kihtideks, energia alatasanditeks ja aatomi orbitaalid.
elektroonilised kihid
aatom esitleb energiatase, mis vastavad seitsmele kihile tuuma ümber ja neis on selle ümber tiirlevad elektronid. Kihte nimetatakse K, L, M, N, O, P ja Q.
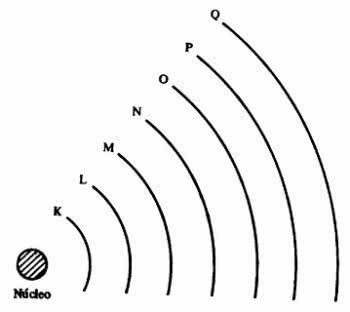
Iga kest võib sisaldada teatud arvu elektrone, nagu on näidatud allolevas tabelis.
| Energiatase | elektrooniline kiht | Maksimaalne elektronide arv |
|---|---|---|
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | O | 32 |
| 6º | P | 18 |
| 7º | Q | 8 |
Näiteks heeliumi aatomil (He) on aatomi number 2 ja seetõttu on tuumas 2 prootonit. Järelikult on aatomi elektrosfääris ainult 2 elektroni, mis asuvad aatomi esimeses ja ainsas elektroonilises kestas, esimeses energiatasandis vastavas K-kestas.
Energia alatasemed
Energiatasemed sisaldavad alamtasemeid, mida tähistavad s, p, d, f. Igale alatasemele mahub maksimaalne arv elektrone, milleks on vastavalt 2, 6, 10 ja 14.

Selle teabe abil on võimalik elektrooniline jaotus teada aatomi ja kõige energilisema elektroni asukohta.
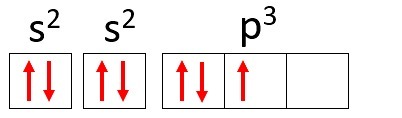
Näide: Lämmastik (N)
Aatomnumber: 7
Elektrooniline levitamine: 1 s2 2s2 2p3
Lämmastikuaatomil on kaks energiataset, K ja L ning selle 7 elektrit hõivavad alam- ja s-tasemed.
K: s2 = 2 elektroni
L: s2 + lk3 = 5 elektroni
Pange tähele, et L-kest võib sisaldada kuni 8 elektroni, kuid lämmastikuaatomis on selles kestas ainult 5 elektroni.
aatomi orbitaalid
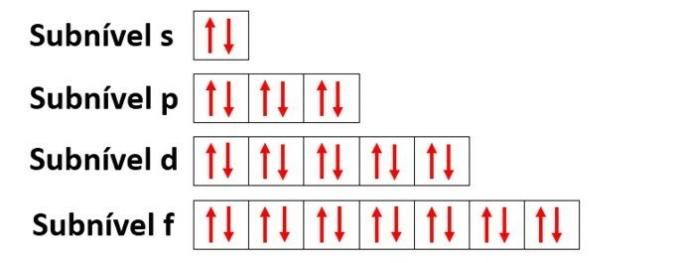
Orbitaalid iseloomustavad piirkonda, kus on kõige tõenäolisem leida elektron elektronkesta (K, L, M, N, O, P, Q) energeetilisest alatasemest (s, p, d, f).
- alamtase: sellel on 1 orbitaal, mis mahutab kuni 2 elektroni
- p alamtase: sellel on 3 orbitaali, mis mahutavad kuni 6 elektroni
- Alamtasemel d: on 5 orbitaali, mis mahutavad kuni 10 elektroni
- Alamtase f: sellel on 7 orbitaali, mis mahutavad kuni 14 elektroni
Kasutades uuesti näiteks lämmastikku ja jaotades selle 7 elektroni aatomi orbitaalides, oleksime:
Aatomitüübid
Prootonite, neutronite ja elektronide arvu jälgides saame aatomeid võrrelda ja neid klassifitseerida isotoopid, isobaarid ja isotoonid.
Keemilist elementi saab määratleda kui aatomite rühm, millel on sama palju prootoneid. Neid aatomeid nimetatakse isotoopideks, kuna neil on sama aatomnumber ja erinevad massid.
Näiteks looduses on vesiniku (H) elemendi 3 isotoopi: protium , deuteerium
ja triitiumi
.
Erinevate keemiliste elementide aatomeid saab liigitada isotoonideks, kui neil on erinev aatomite arv ja mass, kuid sama palju neutroneid.
Isobaarid on erinevate elementide aatomid, see tähendab, et neil on erinev aatomnumber, kuid sama massinumber.
Loe lähemalt isotoopid, isobaarid ja isotoonid.
Aatomimudelid (aatomimudelid)
Kreeka filosoof Aristoteles (384 a. Ç. - 322 a. C) püüdis selgitada kõigi ainete koostist elementidest maa, õhk, tuli ja vesi.
Demokritos (546 a. C - 460 a. C), Kreeka teadlane ja matemaatik, sõnastas idee, et osakeste väiksusel on piir. Tema sõnul muutuvad nad nii väikseks, et neid ei saa enam jagada. Ta nimetas seda osakest "aatomiks".
Suurema osa 19. sajandist oli see Daltoni aatomimudel, Inglise teadlane, kes pakkus välja aatomiteooria, mis läks kaugelt üle iidsete inimeste mõtte.
See teooria ütles, et kõik ained koosnevad väikestest jagamatutest osakestest, mida nimetatakse aatomiteks, mis oleksid nagu piljardikuulid. Aine struktuuri uuringute edenedes avastati, et aatomi moodustavad teised väikesed osakesed, mida nimetatakse subatomaatilisteks osakesteks.
Elektroni avastamisega tomson ta sõnastas mudepudingu nime all tuntud mudeli, mis kirjeldas aatomit kui positiivset sfääri, mille pinnale olid kinnitatud negatiivselt laetud elektronid.
Katsete kaudu füüsik Rutherford leidis, et aatomil olid tühimikud ja elektronid äärmiselt väikese positiivse tuuma ümber. Seega pakkus Rutherford välja tuuma mudeli, mis esindaks aatomit.
Bohr parandas Rutherfordi pakutud mudelit, leides, et elektronid ei pöörle tuuma ümber juhuslikult, vaid spetsiifilistel orbiitidel. Seda mudelit hakati nimetama planetaariumiks.
Loe ka:
- Aatomimudelid
- Thomsoni aatomimudel
- Bohri aatomimudel
- Rutherfordi aatomimudel
- Aatomimudelite areng


