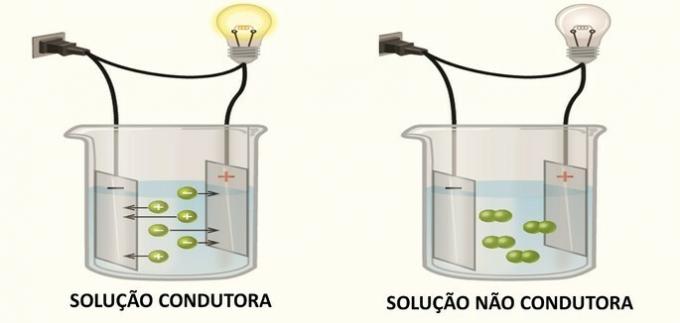
Peamised anorgaanilised funktsioonid on: happed, alused, soolad ja oksiidid.
Anorgaanilistel ühenditel on erinevad omadused ja neid esineb meie igapäevaelus paljudes olukordades. Sel põhjusel arutatakse seda teemat sisseastumiseksamitel, Enemis ja võistlustel palju.
Eksamiteks valmistumiseks oleme loonud selle loendi 15 küsimust kommenteeritud resolutsioonide ja iga anorgaanilise funktsiooni jaoks erineva lähenemisviisiga.
Üldised mõisted
1. (FGV) Mõned ühendid, lahustatuna vees, tekitavad vesilahust, mis juhib elektrit. Allpool toodud ühenditest:
| Mina Kell2AINULT4 |
| II. O2 |
| III. Ç12H22O11 |
| IV. KNO3 |
| V. CH3COOH |
| SAAG. NaCl |
Need moodustavad vesilahust, mis juhib elektrit:
a) ainult I, IV ja VI
b) ainult I, IV, V ja VI
helistama
d) ainult mina ja VI
e) ainult nägin
Õige alternatiiv: b) ainult I, IV, V ja VI.
Elektri juhtivus lahuses toimub elektrilaenguga liikide, ioonide, moodustumise tõttu, nagu Arrhenius oma katsetes leidis.

Kui lahuses moodustuvad ioonid, migreeruvad katioonid (positiivne laeng) negatiivsesse poolusesse ja anioonidesse (negatiivne laeng) migreeruvad positiivsele poolusele, sulgedes elektriskeemi ja võimaldades selle läbida kett.
Ühendid, mis lahuses genereerivad neutraalseid liike, ei juhi elektrit.
Selle teabe kohaselt peame:
Mina JUHTIMINE
Lahuses sool eraldub ja moodustuvad ioonid.
II. EI JUHI
Diatoomne hapnik toatemperatuuril on inertne molekul.
III. EI JUHI
Esitatud valem pärineb sahharoosist - molekulaarsest ühendist, mille veega kokkupuutel selle molekulid hajuvad, kuid ei kaota oma identiteeti.
IV. JUHTIMINE
Lahuses sool eraldub ja moodustuvad ioonid.
V. JUHTIMINE
Äädikhape on nõrk hape, mille lahuses on väike ioniseeritud osa.
SAAG. JUHTIMINE
Lahuses sool eraldub ja moodustuvad ioonid.
2. (Mackenzie-SP)
Ülaltoodud võrrand tähistab reaktsiooni
a) ioonse dissotsiatsiooni.
b) mille reagendiks on dihape.
c) koguionisatsioon, moodustades hüdroksooniumkatiooni.
d) ioniseerimine, tootes fosfiidaniooni.
e) mis täieliku ionisatsiooni korral tekitab monovalentse aniooni.
Õige alternatiiv: c) koguionisatsioon, moodustades hüdroksooniumkatiooni.
Fosforhape on keemiline ühend, mis veega kokkupuutel ioniseerub ja eraldab H-ioone+.
Ionisatsioon toimub kolmes etapis:
| Esimene samm | |
| Teine etapp | |
| kolmas samm | |
| sammude summa |
Katioonid (H+) vabanenud reageerivad veega, moodustades hüdroksooni iooni (H3O+).
Selle põhjenduse kohaselt peame:
a) VALE. Dioosioon toimub ioonilistes ühendites ja fosforhape on molekulaarne ühend.
b) VALE. Fosforhape on triatsiid, kuna sellel on kolm ioniseerivat vesinikku.
c) ÕIGE. Hüdroksooniumkatioon, mida nimetatakse ka hüdrooniumiks, on liik, mis moodustub ioniseeruva vesiniku liitumisel veega.
d) VALE. Toodetud anioon on fosfaat (). Fosfiidvalem on:
e) VALE. Moodustatud anioon () on kolmevalentne, kuna sellel on 3 laengut.
3. Seostage allpool olevad ühendid õigesti nende anorgaaniliste funktsioonidega.
| Mina HBr, H3TOLM4 ja H2CO3 | () happed |
| II. CO2, AINULT2 ja Al2O3 | () alused |
| III. Al2(OH)3, KOH ja NH4oh | () soolad |
| IV. NaCℓ, KNO3 ja BaSO4 | () oksiidid |
Happed on ühendid, millel on ioniseeritavad vesinikud.
(Mina) happed: HBr, H3TOLM4 ja H2CO3
Alustel on hüdroksüülioon.
(III) alused: Al2(OH)3, KOH ja NH4oh
Soolad on katioonide ja anioonide kaudu moodustuvad ioonsed ühendid.
(IV) soolad: NaCℓ, KNO3 ja BaSO4
Oksiidid on ühendid, mis moodustuvad hapniku ja muude elementide, välja arvatud fluori, liitumisel.
(II) oksiidid: CO2, AINULT2 ja Al2O3
Happed
4. Kirjutage järgmiste hapete nimi:
a) HCl ja HBr
Vesinikkloriidhape ja vesinikbromiidhape.
Ülaltoodud ühendid tähistavad hüdraate. Selle klassi hapetel on valem HxA, kus x tähistab vesinike arvu (H) ja A vastab seotud ametaalile.
Nende ainete nomenklatuuri tehakse järgmiselt:
| H | Cl | |
| Hape | Kloor | hüdrauliline |
| Vesinikkloriidhape |
| H | br | |
| Hape | Brom | hüdrauliline |
| vesinikbromiidhape |
b) HNO3 ja HNO2
Lämmastikhape ja dilämmastikhape.
Ülaltoodud ühendid tähistavad kahe oksüdatsiooninumbriga oksühappeid. Selle klassi hapetel on valem HxAO, mis on moodustatud vesinikust, mittemetallist ja hapnikust.
Nende ainete nomenklatuuri tehakse järgmiselt:
| H | N | O3 |
| Hape | Nitr | ich |
| Lämmastikhape. Selle ühendi lämmastikoksiid on +5. |
Madalaim Nox-ühend on dilämmastikhape: HNO2.
| H | N | O2 |
| Hape | Nitr | luu |
| Dilämmastikhape. Selle ühendi lämmastikoksiid on +3. |
c) HClO, HClO2HClO3 ja HClO4
Hüpokloor-, kloor-, kloor- ja perkloorhapped.
Ülaltoodud ühendid tähistavad nelja oksüdatsiooninumbriga oksühappeid. Selle klassi hapetel on valem HxAO, mis on moodustatud vesinikust, hapnikust ja 7A perekonna mittemetallist.
Nende ainete nomenklatuuri tehakse järgmiselt:
| Nox +1 | Hape | jõehobu | elemendi eesliide | luu |
| Nox +3 | Hape | - | elemendi eesliide | luu |
| Nox +5 | Hape | - | elemendi eesliide | ich |
| Nox +7 | Hape | per | elemendi eesliide | ich |
Alternatiivina antud ühendeid nimetatakse järgmiselt:
| H | Cl | O | |
| Hape | jõehobu | kloor | luu |
| Hüpokloorhape. Selles ühendis on kloori Nox +1. |
| H | Cl | O2 |
| Hape | kloor | luu |
| Kloorhape. Selles ühendis on kloori Nox +3. |
| H | Cl | O3 |
| Hape | kloor | ich |
| Kloorhape. Selles ühendis on kloori Nox +5. |
| H | Cl | O4 | |
| Hape | per | kloor | ich |
| Perkloorhape. Selles ühendis on kloori Nox +7. |
5. (UVA-CE) HClO happed4, H2MnO4, H3TOLM3, H4Laupäev2O7, ioniseeruvate vesinike arvu osas võib liigitada:
a) monohape, dihape, triatsiid, tetrahape.
b) monohape, dihape, triatsiid, triatsiid.
c) monohape, dihape, dihape, tetrahape.
d) monohape, monohape, dihape, triatsiid.
Õige alternatiiv: c) monohape, dihape, dihape, tetrahape.
Esitatud hapete ionisatsioon toimub järgmiselt:
Struktuurivalemid näitavad meile, et ioniseeritavad vesinikud on seotud hapnikuga.

Ioniseeruvate vesinike hulga järgi saab happed liigitada:
| HClO4 | ioniseeritav vesinik | ühehape |
| H2MnO4 | Kaks ioniseerivat vesinikku | dihape |
| H3TOLM3 | Kaks ioniseerivat vesinikku | dihape |
| H4Laupäev2O7 | Neli ioniseerivat vesinikku | tetrahape |
Oksühapete puhul on ioniseeritavad vesinikud need, mis on hapnikuga otseselt seotud. Fosforhappel on üks kolmest vesinikust, mis on kinnitatud keskse elemendi, fosfori külge, ja on seetõttu dihape.
6. (UESPI) Olgu happed loetletud allpool koos vastavate ionisatsiooniastmetega protsentides (α%):
|
HClO4 (α% = 97%) |
H2AINULT4 (α% = 61%) |
H3BO3 (α% = 0,025%) |
H3TOLM4 (α% = 27%) |
HNO3 (α% = 92%) |
Kontrollige õiget väidet:
a) H3TOLM4 on tugevam kui H2AINULT4.
b) HNO3 see on kerge hape.
c) HClO4 on nõrgem kui HNO3.
d) H3TOLM4 see on tugev hape.
e) H3BO3 see on nõrk hape.
Õige alternatiiv: e) H3BO3 see on nõrk hape.
Väärtus vastab ionisatsiooniastmele ja arvutatakse järgmiselt:
Mida suurem on väärtus , seda tugevam on hape, sest see tähendab, et lahusesse eraldus rohkem ioniseeritud liike.
Selle põhjenduse kohaselt peame:
a) VALE. Mida suurem on väärtus , seda tugevam on hape. H2AINULT4 on kõrgema ionisatsiooniastmega kui H3TOLM4.
b) VALE. HNO3 selle ionisatsioonitase on suurem kui 90%. See on tugev hape.
c) VALE.4 on kõrgema ionisatsiooniastmega kui HNO3 olles seetõttu temast tugevam.
d) VALE. H3TOLM4 see on mõõdukas hape, kuna selle ionisatsiooniaste jääb vahemikku 5–50%.
e) ÕIGE. H3BO3 selle ionisatsiooniaste on alla 5% ja seetõttu on see nõrk hape.
Alused
7. Sisestage järgmiste aluste nimi:
a) LiOH ja Be (OH)2
Liitiumhüdroksiid ja berülliumhüdroksiid.
Esitatud alustel on kindel tasu ja seetõttu on nomenklatuur järgmine:
LiOH: liitiumhüdroksiid.
Ole (OH)2: berülliumhüdroksiid.
b) CuOH ja Cu (OH)2
Vaskhüdroksiid ja vaskhüdroksiid.
Vasel on kaks oksüdatsiooninumbrit: +1 ja +2. Üks viis muutuva nox-baasi nimetamiseks on järgmine:
| Nox +1 | CuOH | vaskhüdroksiid |
| Nox +2 | Cu (OH)2 | vaskhüdroksiid |
c) Sn (OH)2 ja Sn (OH)4
Tina (II) hüdroksiid ja tina (IV) hüdroksiid.
Tinal on kaks oksüdatsiooninumbrit: +2 ja +4. Muutuva nox-baasi nomenklatuuri saab teha ka järgmiselt:
| Nox +2 | Sn (OH)2 | Tina hüdroksiid II |
| Nox +4 | Sn (OH)4 | Tina hüdroksiid IV |
8. (Fiam-SP) Vesinikkloriidhappe liigsest põhjustatud maohappesuse vastu võitlemiseks on tavaks manustada antatsiidi. Inimeste igapäevaelus leiduvatest allpool loetletud ainetest on happesuse vastu võitlemiseks kõige sobivam:
a) sooda.
b) apelsinimahl.
c) vesi sidruniga.
d) äädikas.
e) magneesiumpiim.
Õige alternatiiv: e) magneesiumpiim.
Antatsiidid on ained, mida kasutatakse mao pH tõstmiseks, kuna vesinikkloriidhappe liig põhjustab pH langust ja sellest tulenevalt ka happesuse tõusu.
Maohappesuse vastu võitlemiseks on soovitatav sisse võtta a põhitunnusega aine, sest maohappega reageerides tekitab see neutraliseeriva reaktsiooni, moodustades soola ja vett.
Selle põhjenduse kohaselt peame:
a) VALE. Soodat ei saa kasutada, kuna selle koostis sisaldab süsinikhapet.
b) VALE. Apelsini ei saa kasutada, kuna selle koostis sisaldab sidrunhapet.
c) VALE. Sidrunit ei saa kasutada, kuna selle koostis sisaldab sidrunhapet.
d) VALE. Äädikat ei saa kasutada, kuna selle koostis sisaldab äädikhapet.
e) ÕIGE. Kasutada tuleks magneesiumpiima, kuna selle koostis sisaldab magneesiumhüdroksiidi.
Moodustatud neutraliseerimisreaktsioon on:
9. (Osec) Tugev alus peab olema seotud OH-rühmaga-:
a) väga elektropositiivne element.
b) väga elektronegatiivne element.
c) poolmetall.
d) metall, mis annab 3 elektroni.
e) mittemetall.
Õige alternatiiv: a) väga elektropositiivne element.
Tugev alus on see, millel on kõrge dissotsiatsiooniaste, see tähendab vabade hüdroksüülioonide lahus.
Hüdroksüülioonil on negatiivne laeng, kuna see suudab hapniku elektronegatiivsuse tõttu end eraldades meelitada elektroni enda juurde.
Seega on väga elektropositiivsel elemendil võime kaotada elektrone ja anda neile hüdroksüülrühm, jäädes lahuses katioonilisele vormile.
a) ÕIGE. Väga elektropositiivsed elemendid nagu leelismetallid ja leelismuldmetallid moodustavad tugevad alused.
b) VALE. Hapnikust elektronegatiivsem element põhjustaks elektronile võistluse.
c) VALE. Semimetallil on suur elektronegatiivsus.
d) VALE. Hüdroksüülioonil on 1 laeng. metall, mis annab 3 elektroni, moodustaks aluse 3 hüdroksüülrühmaga.
Näide:
e) VALE. Kõige tugevamad alused on metallidega moodustunud alused.
soolad
10. Kirjutage järgmiste soolade nimi:
a-N-A2CO3
Naatriumkarbonaat.
See on neutraalse soola tüüp ja selle nomenklatuur on esitatud järgmiselt:
| anioon | katioon |
| Kell+ | |
| karbonaat | naatrium |
| Naatriumkarbonaat |
b) KNaSO4
Naatrium ja kaaliumsulfaat.
See on topeltsoola tüüp ja selle nomenklatuur on sama mis neutraalsoolal ning kahe katiooni nimed on kirjutatud.
| anioon | katioonid | |
| K+ | Kell+ | |
| Sulfaat | kaalium | naatrium |
| Naatrium ja kaaliumsulfaat |
c) NaHCO3
Naatriumvesinikkarbonaat.
See on teatud tüüpi happesool ja selle nomenklatuur on esitatud järgmiselt:
| Vesinike arv | anioon | katioon |
| 1 | Kell+ | |
| Mono | karbonaat | naatrium |
| Naatriumvesinikkarbonaat |
Selle ühendi populaarne nimi on naatriumvesinikkarbonaat.
d) Al (OH)2Cl
Alumiiniumdihüdroksükloriid.
See on aluselise soola tüüp ja selle nomenklatuur on esitatud järgmiselt:
| Hüdroksüülrühmade arv | anioon | katioon |
| 2 | Cl- | Al3+ |
| Di | kloriid | alumiinium |
| Alumiiniumdihüdroksükloriid |
Seda ühendit tuntakse ka kui kahealuseline alumiiniumkloriid.
e) CuSO4. 5 tundi2O
Vasesulfaadi pentahüdraat.
See on hüdraatunud soola tüüp ja selle nomenklatuur on esitatud järgmiselt:
| anioon | katioon | veemolekulide arv |
| Perse2+ | 5 | |
| Sulfaat | vask | penta |
| Vasesulfaadi pentahüdraat |
11. (Unirio) Soolad on ka saadused, mis saadakse hapete ioniseeruvate vesinike täielikul või osalisel neutraliseerimisel aluste või hüdroksiididega vastavalt üldisele reaktsioonile:
Hape + alus Sool + vesi
Mis on selle väite põhjal ainus hape, millel pole kõiki seonduvaid võimalikke tooteid?
a) vesinikkloriidhape toodab ainult neutraalset kloriidsoola.
b) lämmastik toodab ainult nitraadneutraalset soola.
c) fosfor toodab ainult neutraalset fosfaatsoola.
d) sulfiid võib toota kas neutraalset sulfiidsoola või happesoola, happesulfiidi või vesiniksulfiidi.
e) väävelhape võib toota kas neutraalset sulfaatsoola või happesoola, happesulfaati või vesiniksulfaati.
Vale alternatiiv: c) fosfor toodab ainult neutraalset fosfaatsoola.
a) ÕIGE. Soolhappes on ainult üks ioniseeritav vesinik, mis reageerib vee moodustumisele. Seejärel moodustub sool happe anioonil, antud juhul kloriidil, ja aluse katioonil.
Näited:
b) ÕIGE. Lämmastikhappes on ainult üks ioniseeritav vesinik, mis reageerib vee moodustumisele. Seejärel moodustub sool happe anioonist, antud juhul nitraadist, ja aluse katioonist.
Näited:
c) VALE. Fosforhappel on kolm ioniseerivat vesinikku ja seetõttu võib see osaliselt või täielikult ioniseeruda. Sellisel juhul võib moodustada kolme tüüpi sooli:
- Totaalne neutraliseerimine, mis tekitab a neutraalne sool:
- Osaline neutraliseerimine, mis tekitab a happeline sool:
- Osaline neutraliseerimine, mis tekitab a aluseline sool:
d) ÕIGE. Täieliku neutraliseerimise korral moodustub neutraalne sool ja osalise neutraliseerimise korral happeline sool.
- Totaalne neutraliseerimine:
- Osaline neutraliseerimine:
e) ÕIGE. Täieliku neutraliseerimise korral moodustub neutraalne sool ja osalise neutraliseerimise korral happeline sool.
- Totaalne neutraliseerimine:
- Osaline neutraliseerimine:
| Mina Kell2B4O7.10h2O | THE. aluseline sool |
| II. Mg (OH) Cl | B. kahekordne sool |
| III. NaKSO4 | Ç. happeline sool |
| IV. NaHCO3 | D. hüdreeritud sool |
Õige seos nende vahel on:
a) AI, BIII, CIV, DII
b) AII, BIV, CIII, DI
c) AI, BII, CIII, DIV
d) AII, BIII, CIV, DI
Õige alternatiiv: d) AII, BIII, CIV, DI
| AII. aluseline sool: Mg (OH) Cl | Selle struktuuris on hüdroksüülrühm. |
| BIII. kahekordne sool: NaKSO4 | Selle struktuuris on kaks metallkatiooni. |
| CIV. happesool: NaHCO3 | Selle struktuuris on vesinik. |
| DI. hüdreeritud sool: Na2B4O7.10h2O | Selle struktuuris on veemolekulid. |
Oksiidid
13. Kirjutage järgmiste oksiidide nimed:
terasest2 ja ei2O3
Süsinikdioksiid ja dinitrogeentrioksiid.
Need oksiidid on molekulaarsed oksiidid, kuna hapnik on seotud mittemetallidega. Selle klassi nomenklatuur toimub järgmiselt:
| oksügeenide arv | Süsinike arv |
| 2 | 1 |
| Üks süsinikdioksiid või süsinikdioksiid |
| oksügeenide arv | Lämmastikogeenide arv |
| 3 | 2 |
| dinitrogeentrioksiid |
b) Al2O3 ja edasi2O
Alumiiniumoksiid ja naatriumoksiid.
Need oksiidid on ioonoksiidid, kuna hapnik seondub metallidega. Hapnikuga seotud metallidel on fikseeritud laeng. Seetõttu toimub selle klassi nomenklatuur järgmiselt:
Al2O3: alumiiniumoksiid
Kell2O: naatriumoksiid
b) Cu2O ja CuO
Vaskoksiid I ja vaskoksiid II.
Need oksiidid on ioonoksiidid, kuna hapnik on seotud metalliga. Hapnikuga seotud metallil on muutuv laeng. Üks viis selle klassi nimetamiseks on järgmine:
| Nox +1 | Perse2O | vaskoksiid I |
| Nox +2 | CuO | vaskoksiid II |
c) FeO ja Fe2O3
Raudoksiid ja raudoksiid.
Need oksiidid on ioonoksiidid, kuna hapnik on seotud metalliga. Hapnikuga seotud metallil on muutuv laeng. Muutuva mürkoksiidi nomenklatuuri saab teha ka järgmiselt:
| Nox +2 | FeO | raudoksiid |
| Nox +3 | Usk2O3 | raudoksiid |
14. (UEMA) Teatud representatiivse elemendi M neutraalsete aatomite valentskoores on kaks elektroni. Teie normaalse oksiidi ja bromiidi õiged valemid on vastavalt:
(Andmed: O = 6A ja Br = 7A.)
olen2O ja MBr
b) MO2 ja MBr2
c) MO ja MBr2
d) M2O2 aastal2br
aastal2O ja MBr2
Õige alternatiiv: c) MO ja MBr2
M-elementidel on valentskoores kaks elektroni. Teiste elementidega sidumiseks võib see kaotada need kaks elektroni ja moodustada M katiooni.2+.
Hapnik kuulub 6A perekonda ja vajab veel 2 elektroni stabiilsuse saavutamiseks väärisgaasi elektroonilise konfiguratsiooniga, nagu on öeldud okteti reeglis.
Samamoodi vajab 7A perekonnast pärinev broom vaid 1 elektroni, et valentskoores oleks 8 elektroni.
Selle teabe kohaselt peame:
a) VALE. Ühendi M moodustamiseks2O ja MBr, peaks M element moodustama M katiooni+.
b) VALE. Hapnikul on MO-ühendi moodustamisel 2- ja mitte 1-laeng2.
c) ÕIGE. Vastavalt ioonide valentsile on alternatiiv õige.
d) VALE. Bromiidil on 1- ja mitte 2-laeng, nagu on näidatud ühendi M moodustamisel2Br.
e) VALE. Elementkatioonil on 2+ laeng, mitte 1+ laeng, nagu on näidatud M-ühendi moodustamisel.2O.
15. (PUC-MG) Jälgige allpool toodud keemilisi reaktsioone:
| Mina MgO + H2O |
| II. CO2 + H2O |
| III. K2O + 2HCI |
| IV. AINULT3 + 2NaOH |
Vale lause on:
a) II ja IV reaktsioon hõlmab happeoksiide või anhüdriide.
b) Reaktsioonid I ja III hõlmavad aluselisi oksiide.
c) IV reaktsioonis tekkinud soola nimetatakse naatriumsulfaadiks.
d) III reaktsioonis tekkinud soola nimetatakse kaaliumkloriidiks.
e) Oksiidide põhiomadust rõhutatakse, kuna hapnik seondub rohkem elektronegatiivsete elementidega.
Vale alternatiiv: e) Oksiidide põhitunnus on rõhutatud, kuna hapnik seondub rohkem elektronegatiivsete elementidega.
a) ÕIGE. Kui happelised oksiidid nagu süsinikdioksiid ja vääveltrioksiid reageerivad veega, moodustavad nad lahuses happe.
b) ÕIGE. Veega reageerimisel moodustavad aluselised oksiidid nagu magneesiumoksiid ja kaaliumoksiid lahuses aluse.
c) ÕIGE. Kell2AINULT4 on naatriumsulfaadi valem.
d) ÕIGE. KCl on kaaliumkloriidi valem.
e) VALE. Oksiidide põhitunnus on rõhutatud, kuna hapnik seondub rohkemate elementidega. elektropositiivne, leelise ja mulla leelismetallidena, kuna veega reageerides tekivad tugevad alused ning hapetega reageerides soola ja vett.