Termiline tasakaal, mida nimetatakse ka termodünaamiliseks tasakaaluks, on siis, kui kaks keha või ainet jõuavad sama temperatuur.
See termodünaamika mõiste on seotud spontaanse soojusülekandega (soojusenergia), mis toimub kahe kokkupuutuva keha vahel.
Selles protsessis kannab soojem keha soojust jahedamale kehale, kuni mõlemad on samal temperatuuril.

soojusülekande skeem
Energiavahetus kahe keha vahel (soojusenergia) toob kaasa soojusenergia kadumise soojemast kehast ja energiakasvu jahedamast kehast.
Näide
Näitena võime mainida kuuma kohvi ja külma piima segu. Ehkki neil on erinevad algtemperatuurid, kannab kuumim keha (kohv) lühikese aja jooksul soojusenergia üle kõige külmemale (piim). Seega muutub segu termilise tasakaalu tagajärjel leigeks.
Eeldades, et kohv oli temperatuuril 50 ° C ja piim temperatuuril 20 ° C, saavutatakse termiline tasakaal, kui mõlemad on temperatuuril 35 ° C.

kuumus levis
Oluline on märkida, et soojus on energiavahetus ja selle ülekanne võib toimuda kolmel viisil:
- soojusjuhtivus: kineetilise energia suurenemine;
- termiline konvektsioon: konvektsioonivoolude loomine;
- termiline kiiritamine: elektromagnetlainete abil.
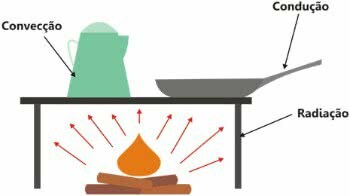
Soojuse leviku tüübid
Loe rohkem: kuumus levis.
Valem
Termilise tasakaalu arvutamiseks kasutatakse järgmist valemit:
Q1 + Q2 + Q3... = 0 või ΣQ = 0
Olemine,
Q: soojushulk (kehatemperatuur)
Seega teame, et kõigi soojusenergiate summa on null.
O mõistlik kuumus see on seotud kehade temperatuurimuutustega. See arvutatakse järgmise valemi abil:
Q = m. ç. Δθ
Kus
Q: mõistliku kuumuse kogus (lubi või J)
m: kehamass (g või kg)
ç: aine erisoojus (cal / g ° C või J / Kg ° C)
Δθ: temperatuuri kõikumine (° C või K)
Loe kaKalorimeetriajaKuumus ja temperatuur.
Tagasisidega sisseastumiseksami harjutused
1. (Mackenzie) Kui segame temperatuuril 70 ° C 1,0 kg vett (tundlik erisoojus = 1,0 cal / g ° C) 2,0 kg veega temperatuuril 10 ° C, saame 3,0 kg vett:
a) 10 ° C
b) 20 ° C
c) 30 ° C
d) 40 ° C
e) 50 ° C
Alternatiiv c) 30 ° C
2. (UFP-RS) Mõelge järgmistele väidetele:
Mina Kui kaks keha on termilises tasakaalus, on neil mõlemal sama palju soojust.
II. Kui kaks keha on termilises tasakaalus, on neil mõlemal sama temperatuur.
III. Kuumus on temperatuuri ülekandumine ühelt kehalt teisele.
IV. Kuumus on transiidis oleva energia vorm.
Ülaltoodud väidetest võib öelda, et:
a) I, II, III ja IV on õiged
b) I, II, III on õiged
c) I, II ja IV on õiged
d) II ja IV on õiged
e) II ja III on õiged
Alternatiiv d) II ja IV on õiged
3. (FATEC-SP) Süsteem A on teise B-ga termilises tasakaalus ja see ei ole teise C-ga termilises tasakaalus. Nii võime öelda, et:
a) süsteemidel A ja C on sama kogus soojust.
b) A temperatuur erineb B temperatuurist.
c) süsteemidel A ja B on sama temperatuur.
d) B temperatuur erineb C temperatuurist, kuid C temperatuur võib olla sama kui A süsteemis.
e) ükski ülaltoodust.
Alternatiivsete c) süsteemide A ja B temperatuur on sama.
4. (UFV-MG) Kui kaks erinevat materjalist keha on termilises tasakaalus ja keskkonnast eraldatud, võib öelda, et:
a) kõige kuumem on kõige väiksema massiga.
b) kontaktist hoolimata ei erine nende temperatuur.
c) kõige kuumem annab sooja kõige külmemale.
d) kõige külmem annab kuumimat kuumust
e) nende temperatuurid sõltuvad nende tihedusest.
Alternatiiv b) kontaktist hoolimata ei erine nende temperatuur.
5. (UFScar-SP) Kaks keha A ja B, massiga mTHE aastalB, on esialgu temperatuuridel tTHE ja sinaBvastavalt t-gaTHE tB. Antud hetkel viiakse nad termokontakti. Pärast termilise tasakaalu saavutamist on meil:
a) t’a> t’b
b) t’a c) t’a = t’b
d) n.d.a.
Alternatiiv c) t’a = t’b
Vt ka mõisteTasakaal füüsikas.


