Keemilise reaktsiooni tekkimiseks on vaja täita nelja põhitingimust, milleks on:
1. Reaktiivid peavad ühendust võtma;
2. Reagentide vahel peab olema keemiline afiinsus;
3. Reagendi osakeste kokkupõrked peavad olema tõhusad;
4. Aktiveerimisenergia tuleb saavutada.
Vaadake lühidalt kõiki juhtumeid:
1.Reagentide vaheline kontakt:
See tingimus on ilmne, sest isegi kui reagentidel on suur afiinsus üksteisega, nagu hapete ja aluste puhul, kui need on eraldatud, reaktsiooni ei toimu. Nad peavad võtma ühendust, et nende osakesed saaksid kokku põrgata, purustades reagentide sidemed ja moodustades toodete sidemed.

2.Keemiline afiinsus:
Nagu nägime, on reagentide kontakti viimine vajalik, kuid mitte piisav. Näiteks kui paneme naatriumi veega kokku, tekib äärmiselt äge reaktsioon, kuid kui paneme kulda, ei näe me mingit vahet. Selle põhjuseks on asjaolu, et erinevatel ainetel on erinev keemiline afiinsus või neil ei pruugi olla üldse afiinsust. Mida suurem on keemiline afiinsus, seda kiirem on reaktsioon.
Mainitud näidetes on naatriumil suur afiinsus veega, nii et selleks, et mitte puutuda kokku õhus oleva niiskusega, ladustatakse metallilist naatriumi petrooleumis. Kuld on inertne, mistõttu kuldmälestised püsivad nii kaua nagu Egiptuse sarkofaagid.

3.Kokkupõrke teooria:
Isegi keemilise afiinsusega ühendites on reaktsiooni kulgemiseks vajalik, et nende osakesed, aatomid või molekulid põrkuksid tõhusalt. Mitte kõik põrkuvad osakesed ei tee seda tõhusalt, kuid šokid, mille tagajärjel puruneb reaktiivsidemed ja uute sidemete moodustumine on need, mis toimuvad õiges orientatsioonis ja koos energiaga piisav.
Ärge lõpetage kohe... Peale reklaami on veel;)
Allpool on toodud kaks ebaefektiivset kokkupõrget ja üks tõhus kokkupõrge, mille tulemuseks on reaktsioon.
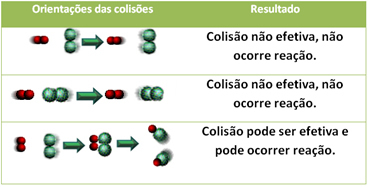
4.Aktiveerimisenergia ja aktiveeritud kompleks:
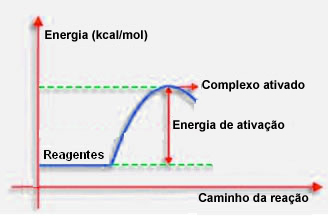
Nagu eelmises punktis öeldud, vajab tõhus kokkupõrge lisaks soodsale juhtimisele ka piisavalt energiat. Iga reaktsiooni toimumiseks vajalikku minimaalset energiahulka nimetatakse aktivatsioonienergiaks.
Kui reaktantide energia on aktiivsusega võrdne või sellest suurem, siis hästi orienteeritud šoki ajal moodustub algselt aktiveeritud kompleks, mis on reaktantide ja ühendi vaheline struktuur tooted. Aktiveeritud kompleksis moodustuvad nõrgenenud reaktiivsidemed ja uute toodete sidemed.
Seega töötab aktivatsioonienergia teatud takistusena reaktsiooni tekkimisele, sest mida suurem see on, seda raskem on reaktsiooni tekkimine. Mõnel juhul on vaja reaktiividega varustada energiat. Näiteks on keedugaasil afiinsus suhelda õhus oleva hapnikuga, kuid matši kokkukutsumisel peame varustama energiat, muidu reaktsiooni ei toimu. Kuid kui see on alanud, eraldab reaktsioon ise piisavalt energiat teiste molekulide aktiveerimiseks ja reaktsiooni jätkamiseks.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Keemiliste reaktsioonide toimumise tingimused"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm. Juurdepääs 27. juunil 2021.



