Pindpinevus on nähtus, mis tekib vedelike, näiteks vee pinnal, moodustades õhukese kile.
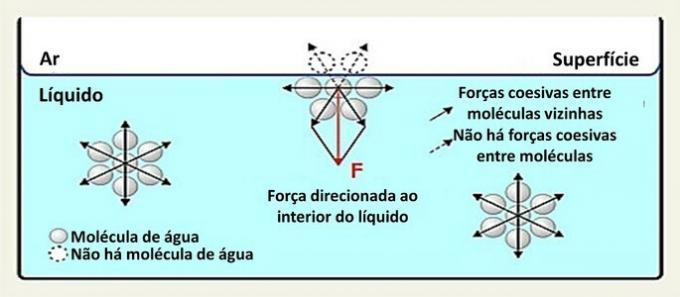
Kui vedelas olekus vesi võtab anuma, võime tajuda vedeliku ja keskkonna eraldumist. Seda seetõttu, et pinnal olevate veemolekulide vastasmõju erineb vedeliku sees olevatest interaktsioonidest.
Pinnal suhtleb veemolekul selle külgedel ja all olevate molekulidega. Seespool on molekul ümbritsetud teiste molekulidega ja vesiniksidemete kaudu toimub vastastikune mõju.
Just selle omaduse tõttu jälgime piiskade tekkimise nähtust. Seetõttu on putukatel võimalik ka vee peal kõndida.
Mis on pindpinevus?
See on õhukese kile moodustumine vedeliku all tänu selle moodustavate molekulide atraktsioonide ebavõrdsusele. See nähtus esineb märgatavamalt vedelikes, millel on molekulidevahelised jõud intensiivne, nagu vesi.
Vedelikus esinevaid liikide vastastikuseid mõjusid nimetatakse sidusjõududeks. Kui vedeliku sees olevad molekulid tõmbuvad naabermolekulide poole igas suunas, siis pinnal olevad molekulid suhtlevad nende all ja kõrval olevate molekulidega.
Vaadake, kuidas vees tekib pindpinevus.
Vesi (H2O) on polaarmolekul, mille moodustavad 2 vesiniku aatomit (positiivsed poolused) ja üks hapniku aatom (negatiivne poolus), mis on ühendatud kovalentsed sidemed. Molekuli positiivset poolust tõmbab naabermolekuli negatiivne poolus, moodustades vesiniksidemed.
Seda tüüpi koostoimed vedelikus on jaotatud igas suunas. Pinnal on jõud suunatud allapoole ja külgsuunas, kuna nende kohal pole veemolekule. See muudab pinna molekulid sidusamaks ja loob elastse kile.
Pindpinevuse ühiku annab jõuühiku ja pikkuse ühiku jagatis, kusjuures kõige sobivam on dyne / sentimeeter (dyne / cm) ja njuuton / meeter (N / m).
Vee pindpinevus on kõrge, mille väärtus on 72,75 dyne / cm. Kuid elavhõbeda, vedel metalli, pindpinevus on veest ligikaudu 7 korda suurem, 475 dyni / cm.
Kas soovite rohkem teada saada? Nii et vaadake järgmisi tekste:
- Vee omadused
- Polaarsed ja apolaarsed molekulid
- Keemilised sidemed
Pindpinevusest tingitud nähtused
Pindpinge on vastutav mõningate nähtuste eest, mida me igapäevases elus jälgime. Peamised neist on:
Loomad, kes käivad vee peal

Putukad, ämblikud ja muud loomad saavad jalutada või puhata Vesi kuna tema käppade jäsemetel on rasvase ainega kaetud karvad ja seetõttu ei pääse nad pinnale ühendatud veemolekulide vahele.
Veepiiskade moodustumine

Veepiisad on sfäärilised, kuna vees on kokkutõmbumine molekulid pindpinevusest põhjustatud pinnast. Sfäär tekib seetõttu, et see on geomeetriline kuju, milles pinna ja mahu vahel on väikseim seos. Seetõttu hoiab sfääriline kuju kõige vähem veemolekule õhuga kokkupuutes.
Harjutused vee pindpinevuse kohta
1. Pindaktiivne aine on aine, mis toimib teise muutmiseks:
a) Osmolaarsus.
b) Pinna pinge.
c) Elektroforees.
d) viskoossus.
e) Osmootne rõhk.
Õige alternatiiv: b) Pinna pinge.
a) VALE. Osmolaarsus on seotud lahustunud aine osakeste kogusega, mis sisalduvad antud lahustimahus.
b) ÕIGE. Nii pesuvahendid kui ka seebid vähendavad vee pindpinevust ja neid nimetatakse üldiselt pindaktiivsed ained, sest nende materjalide molekulid on paigutatud veemolekulide vahele ja vähendavad pinget pealiskaudne.
c) VALE. Elektroforees on meetod molekulide eraldamiseks vastavalt nende laengutele.
d) VALE. Viskoossus on füüsikaline omadus, mis määrab vedeliku voolutakistuse.
e) VALE. Osmootne rõhk on kolligatiivne omadus, mis vastab rõhule, mis tuleb süsteemile avaldada, et vältida osmoosi iseeneslikku teket.
Lisateave selles väljaandes käsitletud probleemide kohta:
- Mateeria omadused
- Kollektiivsed omadused
- Osmootne rõhk
2. Vedelike pindpinevus sõltub otseselt molekulide vastastikmõjuprotsessidest, näiteks vesiniksidemest. Millisel allpool toodud ainest on suurim pindpinevus?
a) benseen
b) oktaanarv
c) etüülalkohol
d) süsiniktetrakloriid
e) etaanhape
Õige alternatiiv: e) etaanhape.
a) VALE. Benseen on süsivesinik, mittepolaarne molekul ega loo vesiniksidemeid.
b) VALE. Oktaan on süsivesinik ja seetõttu on see mittepolaarne molekul, mis ei loo vesiniksidemeid.
c) VALE. Etüülalkohol on kergelt polaarne ühend, mis võib moodustada vesiniksidemeid, kuid molekulide vastasmõju on piiratud.
d) VALE. Süsiniktetrakloriid on mittepolaarne orgaaniline ühend ja seetõttu ei teki vesiniksidemeid.
e) ÕIGE. Karboksüülhappe funktsionaalne rühm (-COOH) võib vesiniksidemeid luua kas hapniku või hüdroksüülvesinikuga.

Lisateave selles väljaandes käsitletud probleemide kohta:
- Molekulide polaarsus
- Orgaanilised funktsioonid
- Süsivesinikud
pindpinevuse katse
Vaadake allolevat videot koos katsega, mis demonstreerib vee pindpinevust.