Kell molekulidevahelised jõud on keemia teema, mis võib kindlasti ilmuda riiklikul keskkooli eksamil (Ja kas). Seetõttu tasub selles artiklis tutvuda selle teema peamise sisuga.
Definitsioon
molekulidevahelised jõud need on erineva intensiivsusega (nõrk, keskmine või tugev) elektrostaatilise tõmbejõud või sidemed aine molekulide vahel, mis hoiavad omavahelist liitu.
Molekulidevaheliste jõudude tüübid
) Indutseeritud dipool
Ja molekulidevaheline jõud mis toimub mittepolaarse karakteristikaga aine molekulide vahel. See juhtub näiteks selliste ainete molekulide vahel nagu O2, H2, ei2, CO2, CH4.
Nende molekulide liit tekib siis, kui nende vahele luuakse dipool. See juhtub siis, kui ühe molekuli elektronid tõrjuvad elektronid teisest välja, luues seeläbi negatiivse ja positiivse pooluse, mis kandub ühest molekulist teise.
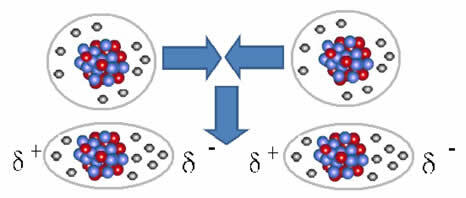
Dipooli moodustumise kujutamine mittepolaarsetes molekulides
Nende molekulide vahel moodustati kaks poolust ja ühe negatiivne pool suhtleb teise positiivse poolusega. Kuna need poolused loodi, on see madala intensiivsusega molekulidevaheline jõud.
B) püsiv dipool
Ja molekulidevaheline jõud mis toimub polaarkarakteristikuga aine molekulide vahel. Näideteks on selliste ainete molekulid nagu HCN, H2O, NH3, CO, CH3Cl.
Nende molekulide liit toimub siis, kui ühe negatiivne poolus suhtleb teise positiivse poolusega.
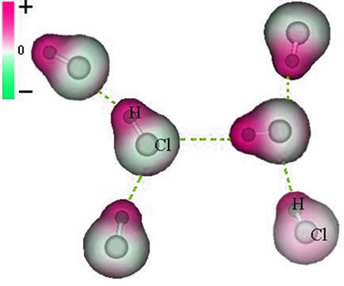
HCl molekulide vahelise püsiva dipooljõu kujutamine
Kuna poolused on juba olemas, on püsiv dipooli molekulidevaheline jõud suurema intensiivsusega kui indutseeritud dipool.
ç) vesiniksidemed
Seda molekulidevaheline jõud see toimub polaarsete molekulide vahel, millel on vesiniku aatom seotud hapniku, lämmastiku või fluori aatomiga.
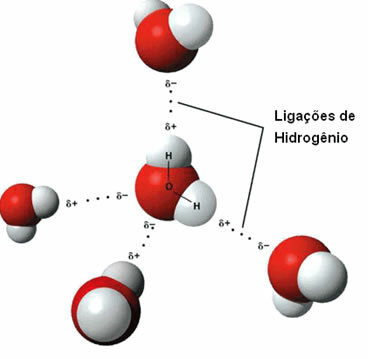
Vesiniksidemete kujutamine veemolekulide vahel
Vesinikside tekib siis, kui ühe molekuli vesinik reageerib teise molekuli hapniku, lämmastiku või fluoriga.
d) dipoolioon
See molekulidevaheline jõud tekib polaarmolekuli, millel on paar mittesiduvaid elektrone, ja lahuses oleva iooni (katioon või anioon) vahel.
Näiteks veemolekulil on hapnikus kaks paari mittesiduvaid elektrone. Kui vesikeskkonnas on ioone, lähevad nad veemolekulile lähemale, kuna selles on pooluseid.
Ärge lõpetage kohe... Peale reklaami on veel;)
Tähtsus
Teadmise tähtsus molekulidevahelised jõud Enemi jaoks see on arusaam, mille nad annavad ainete füüsikaliste olekute, sulamistemperatuuri, keemistemperatuuri ja lahustuvuse osas.
) Seos aine sulamis- ja keemistemperatuuriga
Sulamistemperatuur näitab tahkelt vedelale olekule ülemineku temperatuuri ja keemistemperatuur näitab vedelast gaasilisse olekusse ülemineku temperatuuri.
See lõik on otseselt seotud aine molekulide vastasmõjuga, kuna see, mis eristab ühte füüsikalist olekut teisest, on selle molekulide agregatsioonitase.
Seega, mida intensiivsem on molekulidevaheline jõud, seda kõrgemad on sulamis- ja keemistemperatuurid. Mida vähem intensiivne on molekulidevaheline jõud, seda madalamad on sulamis- ja keemistemperatuurid. Seega saame määratleda sulamis- ja keemistemperatuuri kahaneva järjekorra:
Vesinikside> püsiv dipool> indutseeritud dipool
B) Seos lahustuvusega
Üldiselt peaksime teadma, et sarnane lahustub sarnaselt, see tähendab, et polaarne aine lahustab polaarset ainet ja mittepolaarne aine mittepolaarset ainet.
Kuid lahustunud molekulide ja lahusti molekulide vahel on endiselt võimalik koostoime võimalus. See juhtub ainult siis, kui see uus interaktsioon on suurem kui aine enda molekulide vahel juba olemas.
Molekulidevahelise jõu rakendamise näide Enemis
1. näide: (Enem-2011) Inimese nahk, kui see on hästi niisutatud, omandab hea elastsuse ning pehme ja sileda välimuse. Teiselt poolt, kui see on kuiv, kaotab see oma elastsuse ning tundub läbipaistmatu ja kare. Naha kuivuse vältimiseks tuleb võimaluse korral kasutada niisutavaid niisutajaid, mis on tavaliselt valmistatud glütseriinist ja polüetüleenglükoolist:

Niisutavate ainete veepeetus nahapinnal on tingitud niisutavate ainete hüdroksüülrühmade ja keskkonnas sisalduva niiskuse koostoimest:
a) ioonsidemed
b) Londoni väed
c) kovalentsed sidemed
d) dipool-dipooljõud
e) vesiniksidemed
Vastus sellele küsimusele on vesinikside, kuna veemolekulil on vesinik seotud hapniku aatomiga. Sama juhtub propüleenglükooli ja polüetüleenglükooli molekulidega, mis on seda tüüpi molekulidevahelise jõu esinemise soodne tingimus.
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Molekulidevahelised jõud vaenlasel"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Juurdepääs 27. juunil 2021.