Elektrolüüs on a mittespontaanne keemiline reaktsioon mis hõlmab oksüdatsiooni-reduktsiooni reaktsiooni, mille põhjustab elektrivool.
Elektrolüüsi toimumiseks peab kaasatud elektrivool olema pidev ja piisava pingega.
Selleks, et osalevatel ioonidel oleks teostatavas liikumises vabadus, võib elektrolüüs toimuda sulandumise (tardelektrolüüs) või lahustumise teel (elektrolüüs lahuses).
Elektrolüüsi rakendused
Elektrolüüsiprotsessis toodetakse palju materjale ja keemilisi ühendeid, näiteks:
- alumiinium ja vask
- vesinik ja kloor silindris
- ehted (tsingimisprotsess)
- kiirkeedupott
- magneesiumiratas (auto rummud).
Elektrolüüsi seadused
Elektrolüüsi seadused töötas välja inglise füüsik ja keemik Michael de Faraday (1791-1867). Mõlemad seadused reguleerivad elektrolüüsi kvantitatiivseid aspekte.
THE esimene elektrolüüsi seadus on järgmine väide:
“Elektrolüüsi käigus sadestunud elemendi mass on otseselt proportsionaalne elektrolüütilist elementi läbiva elektrihulgaga”.
Q = i. t
Kus
Q: elektrilaeng (C)
i: elektrivoolu intensiivsus (A)
t: elektrivoolu (de) läbimise ajaintervall
THE teine elektrolüüsi seadus on järgmine väide:
“Elektrolüüsi käigus sama koguse elektriga sadestunud erinevate elementide massid on otseselt proportsionaalsed nende keemiliste ekvivalentidega”.
M = K. JA
Kus
M: aine mass
K: proportsionaalsuse konstant
JA: aine grammiekvivalent
Lisateave artiklist: Faraday konstant.
Klassifikatsioon
Elektrolüüsiprotsess võib toimuda sulamise või lahustumise teel:
Tardelektrolüüs
Tardelektrolüüs on see, mida töödeldakse sulatatud elektrolüüdist, see tähendab Fusioon.
Näitena kasutagem NaCl (naatriumkloriid). Kui kuumutame ainet temperatuurini 808 ° C, sulandub see ja seal olevad ioonid (Na+ ja Cl-) on vedelas olekus suurem liikumisvabadus.
kui elektrivool liigub elektrolüütilisse rakku, Na-katioonidesse+ neid tõmbab negatiivne poolus, mida nimetatakse katoodiks. Juba Cl anioonid-, tõmbab positiivne poolus ehk anood.
Na puhul+ toimub redutseerimisreaktsioon, samas kui Cl-, toimub reaktsioon oksüdeerumine.
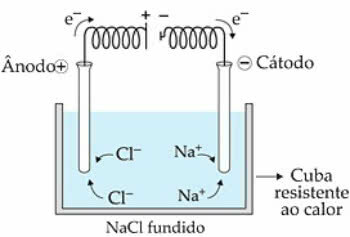
Magnees-NaCl elektrolüüsi skeem
Vesilahuse elektrolüüs
Vesilahuselises elektrolüüsis kasutatakse ioniseerivaks lahustiks vett. Vesilahuses võib elektrolüüsi läbi viia pööratud elektroodide või aktiivsete (või reaktiivsete) elektroodidega.
Inertsed elektroodid: lahuses olev vesi ioniseerub vastavalt võrrandile:
H2O ↔ H+ + OH-
Koos dissotsiatsioon NaCl-st on meil:
NaCl → Na+ + Cl-
Seega H katioonid+ ja edasi+ võib eralduda negatiivsel poolusel, samas kui OH anioonid- ja Cl- saab vabastada positiivse pooluse juures.
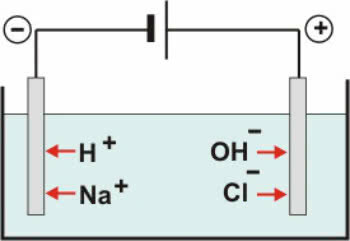
NaCl vesilahuse skeem
Katioonides toimub redutseerimisreaktsioon (katoodne redutseerimine), anioonides aga oksüdatsioonireaktsioon (anoodne oksüdatsioon).
Nii et meil on elektrolüüsireaktsioon:
2 NaCl + 2H2O → 2 tolli+ + 2 OH- + H2 + Cl2
Selle põhjal võime järeldada, et NaOH molekulid jäävad lahusesse, samas kui H2 vabaneb negatiivsel poolusel ja Cl2, positiivsel poolusel.
Selle protsessi tulemusena saadakse samaväärne võrrand:
2 NaCl + 2H2O → 2 NaOH + H2 + Cl2
Aktiivsed elektroodid: sel juhul osalevad aktiivsed elektroodid elektrolüüsis, kuid nad kannatavad korrosiooni all.
Näiteks on meil elektrolüüs vasksulfaadi vesilahuses (CuSO4):
CUSO4 → Cu2 + OS 2-4
H2O → H+ + OH-
 CuSO vesilahuse skeem4
CuSO vesilahuse skeem4
Sel juhul korrodeerub vaskanood:
Perse0 → Cu2+ + 2e-
Seda seetõttu, et vastavalt elektroodide standardpotentsiaalidele on elektrivoolul lihtsam elektronide eemaldamine Cu-st0 kui OS 2-4 või oh-.
Seetõttu toimub negatiivsel poolusel järgmine elektrolüüsireaktsioon:
2e- + Cu2+ → Cu
Positiivsel poolusel on meil elektrolüüsireaktsioon:
Cu → Cu2+ + 2e-
Lõpuks, kui lisame kaks elektrolüüsi võrrandit, on selle tulemuseks null.
Kas soovite teemast rohkem teada saada? Loe artikleid:
- Ioon, katioon ja anioon
- Keemilised reaktsioonid
- Oksüdatsioonireaktsioonid
Aku ja elektrolüüs
Elektrolüüs põhineb aku vastupidisel nähtusel. Elektrolüüsil ei ole protsess spontaanne, nagu see juhtub patareides. Teisisõnu muudab elektrolüüs elektrienergia keemiliseks energiaks, rakk aga keemilisest energiast.
rohkem teada Elektrokeemia.
Harjutused
1. (Ulbra-RS) Metallilist kaaliumi saab toota kaaliumkloriidi tardelektrolüüsil. Märkige sellest avaldusest õige alternatiiv.
a) Elektrolüüs on protsess, mis hõlmab elektrivoolust ajendatud oksüdatsiooni-redutseerimise ja redutseerimise reaktsioone.
b) kaaliumkloriidi tardelektrolüüs toimub toatemperatuuril.
c) Kaaliumi leidub looduses redutseeritud kujul (K0).
d) Elektrolüüsireaktsioon toimub ultraviolettkiirguse abil.
e) Kaaliumkloriidi elektrolüüsi käigus toimub metallilise kaaliumi saamiseks elektronide ülekandumine kaaliumist klooriks.
Alternatiiv
2. (UFRGS-RS) Elektrolüüsielemendi katoodis on alati:
a) Metalli sadestamine.
b) Redutseerimise poolreaktsioon.
c) elektrivoolu tootmine.
d) vesinikgaasi eraldumine.
e) Keemiline korrosioon.
B. Alternatiiv
3. (Unifor-CE) Järgmised väited on seotud elektrolüüsiga:
Mina Elektrolüüsi reaktsioonid tekivad elektrienergia tarbimisel.
II. Glükoosi vesilahuseid ei saa elektrolüüsida, kuna need ei juhi elektrivoolu.
III. Soolalahuste elektrolüüsil metalli katioonid oksüdeeruvad.
Võime öelda, et ainult:
a) Mul on õigus.
b) II on õige.
c) III on õige.
d) I ja II on õiged.
e) II ja III on õiged.
Alternatiivne
4. (FEI-SP) Kaks keemiatudengit viisid läbi BaCl elektrolüüsi2; esimene vesine ja teine tuline. Tulemuse kohta võime öelda, et mõlemad said:
a) H2 see on2 anoodide juures.
b) H2 ja Ba anoodide juures.
c) Cl2 ja Ba elektroodidel.
d) H2 katoodide juures.
e) Cl2 anoodide juures.
Alternatiivne ja
5. (Vunesp) "Keemiata bassein”On veepuhastusega reklaam. On aga teada, et töötlemine seisneb naatriumkloriidi lisamises vette ja selle läbimises vesi läbi anuma, mis on varustatud pliiga ühendatud vase ja plaatina elektroodidega auto.
a) Selle teabe põhjal arutage, kas reklaamisõnum on õige
b) Arvestades inertseid elektroode, kirjutage kaasatud reaktsioonide võrrandid, mis õigustavad eelmist vastust.
a) Reklaamisõnum ei ole õige, kuna toimub keemiatoodete moodustumine.
b) 2 NaCl + 2H2O → 2 NaOH + H2 + Cl2 (kloori moodustav reaktsioon, kasulik basseinivee töötlemisel)
2 NaOH + Cl2 → NaCl + NaClO + H2O (reaktsioon, mis moodustab tugeva bakteritsiidi NaClO)