Tekstis "Ainete polaarsuse ja lahustuvuse suhe" nägite, et see üldiselt lahustab polaarsed ained lahustuvad lahustites, mis on samuti polaarsed ja mittepolaarsed ained lahustuvad ka lahustites mittepolaarne. Kuid see ei ole reegel, mida saab rakendada kõigi lahustuvusjuhtumite korral.
Näiteks suhkur lahustub vees, kuid õli mitte. On tõsi, et vee ja suhkru molekulid on polaarsed, samas kui õlimolekulid on mittepolaarsed, kuid need on nende isoleeritud ainete molekulide omavahelised molekulidevahelised jõud, mis annavad meile selle kohta selgituse fakt.

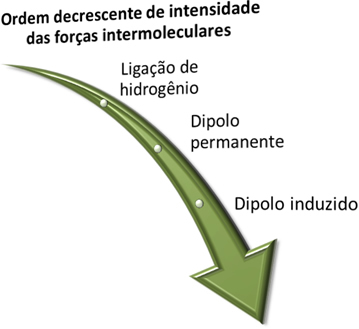
Enne kui näeme, mis need jõud on, pidage meeles, et intensiivsuse mõttes tugevam on vesinikside, millele järgneb püsiv dipooljõud ja kõige nõrgem on indutseeritud dipooljõud.
Nii vee kui ka suhkru molekulid (sahharoos - C12H22O11), esinevad vesinikuaatomitega seotud hapniku aatomid, moodustades rühmad ─ O ─ H. See tähendab seda veemolekulide ja suhkrumolekulide vahel võib esineda molekulidevahelisi vesiniksidemeid.
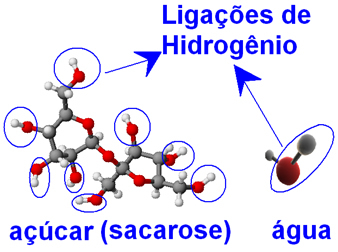
Sellepärast suudavad veemolekulid tihedalt kokku seotud suhkrumolekulid kristallidena mähkida ja eraldada, takistades nende uuesti liitumist. Seega on suhkur vees hästi lahustuv ja me võime selle kuni 33 g lahustada 100 g vees temperatuuril 20 ºC.
Nüüd on õli ja vesi segunematud. See ei tähenda, et õli vesi ei tõmba, kuna asjaolu, et see levib veepinnal, mitte kuju sfääriline, näitab meile, et ta otsib kuju, milles suurem kogus õlimolekule on õlimolekulidega kontaktis. Vesi.
Ärge lõpetage kohe... Peale reklaami on veel;)
Kuid, veemolekulide vaheline külgetõmbejõud on palju suurem (vesinikside) kui õli- ja veemolekulide vahel. Seetõttu ei saa õlimolekulid lõhkuda sidet kahe naaberveemolekuli vahel.
See viib meid järeldusele, et:
“Kui olemasolev molekulidevaheline jõud on võimalikust uuest vastasmõjust intensiivsem, siis lahustunud aine ei lahustu, alles jääb algne side. Kuid kui uus interaktsioon on tugevam, lahustub lahustunud aine, purustades ainete molekulidevahelised sidemed. "
Teine näide, mis näitab molekulidevaheliste jõudude olulisust materjalide lahustuvuses, on see, kui meil on joodi, vett ja benseeni. Alloleval diagrammil on jood lahustuv benseenis hästi ja vees lahustub kergelt, vees ja benseenis on täiesti segunematu ja kui meil on benseeni ja vee segu ning seejärel lisame joodi, lahustub see ainult benseen:
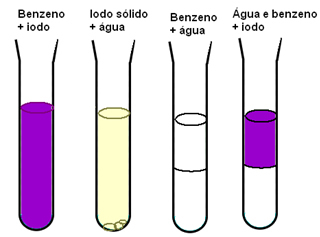
Benseen ja jood on mittepolaarsed, nende segamine on kergem kui veega, mis on polaarne. Mis aga tegelikult seletab, mis juhtub, on see, et mittepolaarsete molekulide vahelised molekulidevahelised indutseeritud dipooljõud on vee vesiniksidemetega võrreldes nõrgad.
Seega, kuna veemolekulide vahelised olemasolevad koostoimed on võimalikest uutest tugevamad vastastikmõjude korral vesiniksidemed ei purune ja benseeni ja segamisel täheldatakse kahefaasilist süsteemi Vesi.
Uued koostoimed, mis moodustuvad joodimolekulide ja benseeni molekulide vahel, on intensiivsemad kui need, mis toimuvad nende isoleeritud ainete molekulide vahel.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Molekulidevahelise tugevuse ja ainete lahustuvuse suhe"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/relacao-entre-forca-intermolecular-solubilidade-das-substancias.htm. Juurdepääs 27. juunil 2021.