Kui ütleme sõna „tasakaal“, tuleb meelde lõputult püsiv objekt. See on siiski vaid üht liiki tasakaal, nn “Staatiline tasakaal”.
Seal on ka “Dünaamiline tasakaal”. Selles, nagu nimigi ütleb, pole ainsatki hetke, kus kõnealune objekt või nähtus oleks endiselt. Näiteks mõistmiseks vaadake allolevat joonist ja pange tähele, et anumasse langev veekogus on võrdne sellest välja voolava kogusega, hoides veetaset konstantsena. Sel juhul ütleme, et on olemas dünaamiline tasakaal, tasakaal liikvel.

Selline tasakaal tekib pöörduvad reaktsioonid, see tähendab nendes reaktsioonides, mis toimuvad mõlemas suunas. Samal ajal, kui reagentide molekulid muundatakse saadusteks, reageerivad saaduste molekulid üksteisega reaktantide moodustamiseks. Reaktsiooni pöörduvust tähistavad nooled mõlemas suunas:
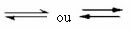
Kui otsese reaktsiooni (toote moodustumise) arengukiirus on võrdne pöördreaktsioon (reaktiivide moodustumine) konstantsel temperatuuril tähendab, et reaktsioon on jõudnud oma tasakaalu keemiline. Ja reaktsioonide korral, kus reagentides ja saadustes on ainult molekule, on meil a molekulaarne tasakaal.
Järgnev on näide reaktsioonist, mis toimub gaasilise vesiniku (H2) ja joodigaas (I2) vesinikjodiidi (HI) moodustamiseks:
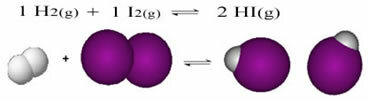
Reaktsiooni alguses oli otsese reaktsiooni arengutempo suurem, pärast seda, kui kogu reagentide kontsentratsioon oli maksimaalne ja saaduste kontsentratsioon oli null. Nii et ka pöördreaktsiooni arengukiirus oli null.
Kuid aja jooksul reageerivad vesiniku- ja joodigaasid, saades toote. Nii hakkab reagentide kontsentratsioon vähenema ja ka nende arengukiirus väheneb.
Kui toodete kontsentratsioon suureneb ja reagentide kontsentratsioon väheneb, hakkab pöördreaktsiooni arengukiirus suurenema. Kui temperatuuri hoitakse konstantsena, saabub aeg, mil kaks arengukiirust jäävad samaks, mis näitab, et reaktsioon on jõudnud keemilisse molekulaarsesse tasakaalu.
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm


