Kovalentseid sidemeid (elektrone jagades) ühendite füüsikaliste ja keemiliste omaduste analüüs näitab meile, et nende materjalide vahel on suuri erinevusi. Kuid enne nende omaduste vaatamist vaatame, mis vahe on molekulaarsetel ja kovalentsetel ainetel.
Kell molekulaarsed ained need on need, mis tekivad siis, kui aatomid on kovalentsete sidemete kaudu seotud, andes tulemuseks kindla arvuga molekule.
Kuid kovalentne side võib tekitada ühendeid ka väga suure ja määramatu aatomite arvuga võrgustruktuuris, mis on makromolekulid. Selliseid aineid nimetatakse kovalentsed ühendid või kovalentsed võrgu tahked ained. Mõned näited nendest ühenditest on: teemant (C), grafiit (C), ränidioksiid (SiO2) ja ränikarbiid (SiC).
Vaatame nüüd selle peamisi omadusi:
- Füüsikaline olek toatemperatuuril: Ümbritsevatel tingimustel leitakse molekulaarseid ja kovalentseid ühendeid kolmes füüsilises seisundis (tahke, vedel ja gaasiline).
Näited:
O Tahke: suhkur (sahharoos), ränidioksiid (liiv), teemant, grafiit;
O Vedelik: vesi, atsetoon, etanool;
O Gaasiline: Vesiniksulfiid, gaasiline kloor, gaasiline broom, gaasiline vesinik.

- Sulamis- ja keemistemperatuur: Üldiselt on nende ainete sulamis- ja keemistemperatuurid väiksemad kui ioonainete omad.
Kovalentsete ainete keemistemperatuur on kõrgem kui molekulaarsetel, alati üle 1000 ° C. Selle põhjuseks on asjaolu, et kuna nende molekulid on tihedamalt ühendatud ja moodustavad kristallvõre, on nende oleku muutmiseks vajalik anda rohkem energiat.
Kovalentsete ja molekulaarsete ühendite keemis- ja sulamispunkte segavad kaks tegurit: a molaarmass ja molekulidevaheline jõud.
Ärge lõpetage kohe... Peale reklaami on veel;)
Mida suurem on molaarmass, seda suurem on molekuli inerts ja sellest tulenevalt ka kõrgem keemis- ja sulamistemperatuur. Kui molaarmassid on ligikaudsed, vaatleme molekulidevahelisi jõude. Kõige intensiivsem molekulidevaheline jõud on vesiniksidemete jõud, mis viib kõrgema keemis- ja sulamistemperatuurini. Vaheprodukt on püsiv dipool ja nõrgim, mis viib madalama keemis- ja sulamistemperatuurini, on indutseeritud dipool.
- Elektrivool: Puhtal kujul ei juhi nii vedelikud kui ka tahked ained elektrivoolu.
Erandiks on grafiit, mis juhib elektrivoolu tahkel kujul, kuna selle kaksiksidemega elektronid resoneerivad ja on seetõttu teatud liikuvusega.
- Lahustuvus: Polaarid lahustuvad polaarseteks ja mittepolaarsed lahustuvad mittepolaarseteks.
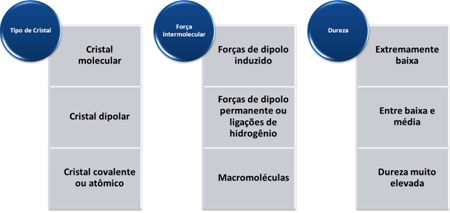
- Visadus: Kovalentsete ainete vastupidavus löögile või mehaanilisele löögile on madal. Üldiselt on need habras tahke aine, nagu on näidatud naatrium- ja kaltsiumsilikaatidest moodustuva klaasi puhul.

- Sitkus: Üldiselt on neil kõrge kõvadus. Välja arvatud grafiit, kuna selle süsinikuaatomid on seotud kolme teise süsinikuaatomiga, moodustades teatud liikuvusega kuusnurksed plaadid, muutes selle pehmeks. Seetõttu kasutatakse seda isegi määrdeainena.
Nende ainete kõvadus varieerub vastavalt kristallide tüübile, nagu on näidatud allolevas tabelis:
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Kovalentsete ja molekulaarsete ühendite omadused"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/propriedades-dos-compostos-covalentes-moleculares.htm. Juurdepääs 28. juunil 2021.
Ioonsed ühendid, ioonühendite põhiomadused, ioonide omavaheline sidumine, elektronide lõplik ülekanne, elektrostaatilised tõmbejõud ioonide, negatiivsete ja positiivsete ioonide, anioonide, katioonide, ioonsideme, molekulaarstruktuuri vahel ta