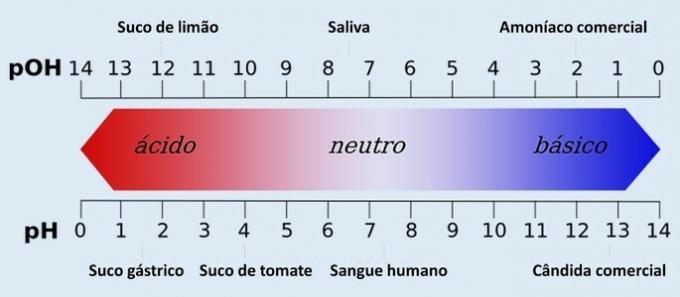
PH vastab lahuse vesinikupotentsiaalile. See määratakse vesinikioonide (H+) ja selle abil mõõdetakse antud lahuse happesuse, neutraalsuse või leeliselisuse määra.
Lisaks pH-le on olemas ka teine kogus, mis määrab veesüsteemi happesuse ja aluseluse: pOH (hüdroksüülioonne potentsiaal). Sellel skaalal on sama funktsioon kui pH-l, ehkki seda kasutatakse vähem.
pH skaala
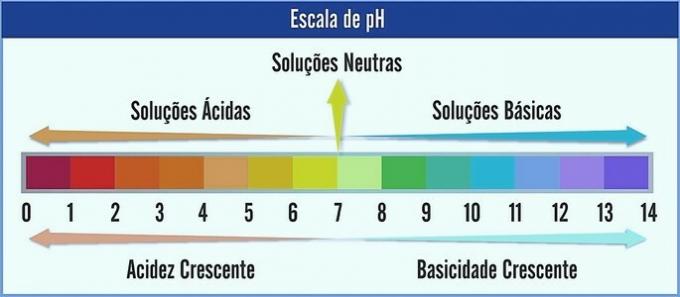
PH on esitatud skaalal vahemikus 0 kuni 14. See mõõdab lahuse happesust ja aluselisust.
Seetõttu on pH 7 neutraalne lahus (nt puhas vesi). Enne seda peetakse happelisteks lahusteks (happeline pH) ja pärast 7 on aluselised lahused (leeliseline pH).
Selle tähelepaneku korral suureneb happeline iseloom paremalt vasakule. Põhitegelane vasakult paremale. Pange tähele, et mida madalam on pH väärtus, seda happelisem lahus on.
Lisateave aadressil:
- Puhverlahus
- Tiitrimine
- Neutraliseerimisreaktsioon
Näited
Happelahused
| Lahendus | pH |
|---|---|
| Maomahl | 2,0 |
| Sidrunimahl | 2,2 |
| Äädikas | 3,0 |
| Kohv | 5,0 |
| Lehmapiim | 6,4 |
Põhilahendused
| Lahendus | pH |
|---|---|
| inimese veri | 7,35 |
| Merevesi | 7,4 |
| Naatriumvesinikkarbonaat | 8,4 |
| Magneesiumpiim | 10,5 |
| Pleegita | 12,5 |
Kuidas arvutada pH?
1909. aastal tegi Taani keemik Soren Sörensen (1868–1939) ettepaneku, et lahuste happesus, mõõdetuna H-ioonide kontsentratsioonidena+, lasi väärtused mõistmise hõlbustamiseks logaritmide abil ümber kujundada.
Temperatuuril 25 ° C on vee ioonprodukt 10–14 mol2/ L2.
Kologaritmi rakendamine avaldises peame:
Selle avaldise abil saame lahutamise teel saada vastava väärtuse ühest skaalast teise.
Kuidas pH-d mõõta?
PH reguleerimine on oluline mitte ainult teaduslikel eesmärkidel, vaid ka igapäevaelus.
Tuleb kontrollida basseini pH-taset, samuti akvaariumi pH-d ja isegi mulla pH-d, et võimaldada teatud tüüpi põllukultuure.
Allpool on toodud peamised viisid pH mõõtmiseks.
happe-aluse indikaator
Lahuse pH mõõtmiseks kasutatakse nn happe-aluse näitajaid. Need on ained, mis muudavad värvi, mis näitab lahuse iseloomu. Kõige enam kasutatakse näitajaid: lakmus ja fenolftaleiin.

Sammulugeja
Lisaks näitajatele saab lahuse pH-d mõõta peagomeetriks nimetatava instrumendi abil. See elektrooniline seade mõõdab lahuse elektrijuhtivust ja teisendab selle pH väärtuste skaalaks.

Tagasisidega sisseastumiseksami harjutused
1. (Enem / 2014) Teadlane mõistab, et ühe klaasi silt, milles ta seedeensüümide kontsentraati hoiab, on loetamatu. Ta ei tea, millist ensüümi klaas sisaldab, kuid kahtlustab, et see on mao proteaas, mis töötab maos valkude seedimisega.
Teades, et seedimine maos on happeline ja sool on aluseline, paneb ta toiduga kokku viis katseklaasi lisage ensüümi kontsentraat kindlaksmääratud pH-ga lahustele ja oodake, kas ensüüm toimib nende.
Katseklaas, milles ensüüm peab toimima teadlase hüpoteesi õigsuse näitamiseks, sisaldab järgmist:
a) kartulikuubik lahuses, mille pH on 9
b) lihatükk lahuses, mille pH on 5
c) keedetud munavalge lahuses, mille pH = 9
d) nuudlite osa lahuses, mille pH on 5
e) võipall lahuses, mille pH on 9
Õige alternatiiv: b) lihatükk lahuses, mille pH on 5.
Proteaas on ensüüm, mis seedib valke ja kuna see on maos, toimib see maos, mille pH on happeline.
Alternatiivide analüüsimisel peame:
a) VALE. Kartul sisaldab palju süsivesikuid ja kontsentraadi pH on aluseline.
b) ÕIGE. Liha sisaldab valke ja ensüümid võivad sellele mõjuda ning kontsentraadi pH on happeline, nagu maos.
c) VALE. Kontsentraadi pH on aluseline.
d) VALE. Pasta sisaldab palju süsivesikuid.
e) VALE. Kontsentraadi pH on aluseline.
2. (Udesc / 2009) "Happevihm" on mõiste, mis viitab sademetele vihma atmosfäärist, kus on rohkem kui tavaliselt lämmastik- ja väävelhappeid.
Happevihma eelkäijad pärinevad nii looduslikest allikatest, nagu vulkaanid ja lagunev taimestik, kui ka protsessidest tööstusheited, peamiselt kütuste põletamisel tekkivad vääveldioksiid ja lämmastikoksiidid kivistised.
Normaalseks peetava vihmavee pH on 5,5 (süsinikdioksiidi lahustamisel tekkiva süsinikhappe olemasolu tõttu). Kõrgelt tööstuspiirkonda jälginud keemik märkis, et vihmavee pH oli 4,5.
Arvestades, et happesus on seotud H kontsentratsiooniga3O+, on õige öelda, et pH väärtusega 4,5 oli:
a) kaks korda tavalisest tavalisem.
b) kaks korda happelisem kui tavaliselt.
c) kümme korda põhilisem kui tavaliselt.
d) kümme korda happelisem kui tavaliselt.
e) sada korda happelisem kui tavaliselt.
Õige alternatiiv: d) kümme korda happelisem kui tavaliselt.
Vastavalt avaldistele pH = - log [H+] ja [H+] = 10-H, Me peame:
pH = 5,5
[H+] = 10-5,5
pH = 4,5
[H+] = 10-4,5
Väärtuste erinevus on: 10- 5,5 - ( - 4,5) = 10 -1
Kuna pH-skaala on logaritmiline skaala, võrdub ühe ühiku muutmine 10 korda happelisema lahusega.
3. (UFMG / 2009) Mõelge klaasis sisalduvale segatud veekogusele ja sidrunimahlale. Vaadake üle kolm selle süsteemi kohta käivat väidet:
Mina Süsteem on happeline.
II. Süsteemi pH on suurem kui 7.
III. Süsteemis H-ioonide kontsentratsioon+ on suurem kui OH–.
Selle analüüsi põhjal on ÕIGE öelda, et:
a) õiged on ainult väited I ja II.
b) õiged on ainult väited I ja III.
c) õiged on ainult väited II ja III.
d) kõik kolm väidet on õiged.
Õige alternatiiv: b) õiged on ainult väited I ja III.
Mina ÕIGE Sidrun sisaldab sidrunhapet, mis lahuses eraldab H ioone+ ja nii on süsteem happeline.
II. VALE. PH on alla 7, iseloomustades happelist süsteemi: mida lähemal 0 on lahuse pH, seda happelisem see on.
III. ÕIGE Happeline pH on tingitud H-ioonide suurest kontsentratsioonist+ lahuses, kuna pH = - log [H+].
Kommenteeritud resolutsiooniga lisaküsimuste korral kontrollige kindlasti järgmist:Harjutused pH ja pOH kohta.


