Hübridiseerimine on mittetäielike aatomorbitaalide sulandumisele või liitumisele antud nimi, mis suurendab nende arvu kovalentsed sidemed mida aatom suudab. Pidades meeles, et orbitaal on aatomi piirkond, kus on suurem tõenäosus elektroni leida.
Teada aatomi loodud sidemete arvu ja mõista selle nähtust hübridiseerimine, on vaja teada aatomi kohta mõningaid põhipunkte:
1O punkt: energia alamtase
Energia alatasemed, mis aatomil võivad olla, on s, p, d, f.
2O punkt: orbitaalide arv alataseme kohta
Igal energia alatasemel on erinev hulk orbitaale, nagu näeme allpool:
Alamtase s: 1 orbitaal;
p alamtase: 3 orbitaali;
Alamtasand d: 5 orbitaali.
Nende orbitaalide üldine esitus toimub järgmiselt:
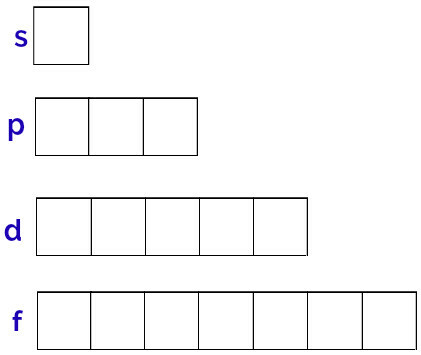
Iga alataseme orbitaalide kujutamine
Pauli sõnul võib orbiidil olla maksimaalselt 2 elektroni koos keerutab (pöörlevad liikumised) vastupidine.
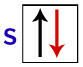
S orbitaali kujutamine selle elektronidega
Hundi sõnul saab alataseme orbitaal oma teise elektroni alles siis, kui kõik selle alamtaseme orbitaalid on esimese elektroni juba kätte saanud.
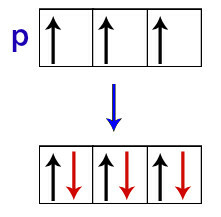
Elektronide jaotus p alataseme orbitaalides
3O punkt: elektrooniline levitamine
Hübridiseerumise ja aatomi loodud sidemete arvu mõistmiseks on oluline läbi viia elektrooniline jaotus Linus Paulingi diagrammil.

Linus Paulingi diagramm
Pidades meeles, et maksimaalne elektronide arv igas alatasemes on:
s = 2 elektroni;
p = 6 elektroni;
d = 10 elektroni;
-
f = 14 elektroni.
Ärge lõpetage kohe... Peale reklaami on veel;)
Pärast seda lühikest ülevaadet saame nüüd määratleda mis on hübridisatsioon. Selleks kasutame keemilist elementi boor (aatomnumber = 5) näitena.
Booride elektroonilise levitamise korral on meil:
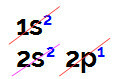
Elektrooniline boorijaotus Linus Paulingi diagrammil
Selles jaotuses on võimalik täheldada, et booril on alamtasemel 2 elektroni ja p-alatasemel 1 elektron valentsikiht.
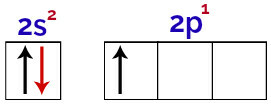
Elektronid boorvalentsikihi orbitaalides
Kuna booril on 1 mittetäielik orbitaal, peaks seetõttu tegema ainult ühe kovalentse sideme, kuna sidemete arv on alati otseselt seotud mittetäielike orbitaalide arvuga.
Seega, kui booriaatom saab energiat väliskeskkonnast, erutuvad selle elektronid, eriti valentskoores olevad. See põhjustab ühe s-orbitaali elektronide lahkumise ja hõivab ühe tühja p-orbitaalist, mille tulemuseks on 3 mittetäielikku aatomorbitaali, nagu näete järgmisel pildil:

Boornatomi ergastatud oleku kujutamine
Lõpuks on puuduliku s orbitaali liit mittetäielike p orbitaalidega. Seda liitu nimetatakse hübridiseerimine. Kuna meil on s orbitaali liitmine kahe p-ga, siis seda nimetatakse hübridiseerimine sp2.
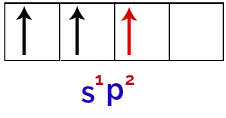
Hübridiseeritud orbitaalide kujutamine boori aatomis
Lisaks boorile läbivad hübridiseerumise nähtused ka mitmed muud keemilised elemendid, näiteks väävel (S), ksenoon (Xe), fosfor (P), süsinik (Ç), berüllium (Ole).
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Mis on hübridiseerimine?"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm. Juurdepääs 27. juunil 2021.
Seonduv energia, keemilised reaktsioonid, sidemete purustamine, energia varieerumise uurimine, reaktsioonide entalpia varieerumine, energiavarustus, reaktiivide ühendamise katkemine, endotermiline protsess, energia eraldumine, energiast vabanev energia moodustumine
