Kell molekulidevahelised jõud need on elektrostaatilise tõmbejõud, mille ülesanne on ühendada molekule (molekulaarühendeid), hoides neid tahkes või vedelas olekus. Need on äärmiselt olulised, kuna määravad kindlaks kõik füüsikalised omadused (sulamistemperatuur, keemistemperatuur, tihedus ja lahustuvus) aineid.
Selles tekstis uurime molekulidevaheliste jõudude ja ainete keemistemperatuuri suhe. Esialgu meenutagem kolme olulist tüüpi molekulidevahelisi jõude, mis on:
♦ dipool dipool: on polaarmolekulides esinev jõud. Kuna nendel molekulidel on positiivne ja negatiivne poolus, põhineb dipool-dipooljõud atraktsioonil ühe molekuli positiivse ja teise negatiivse otsa vahel. Näited: HCl, HBr, SO2 ja PH3
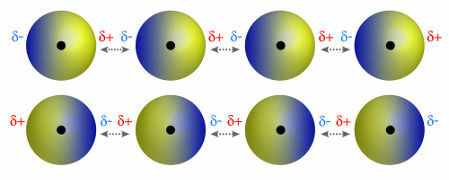
Molekulid, millel on positiivne ja negatiivne poolus, tõmbavad üksteist ligi
♦ Indutseeritud dipool: on molekulidevaheline jõud, mis esineb ainult mittepolaarsetes molekulides (neil pole pooluseid). Kui läheneb kaks apolaarset molekuli, toimub nende pilvede hetkeline deformatsioon elektronid, mis põhjustab molekuli elektronides tasakaalustamatust, mis jaotuvad a tema jaoks erinev. Sel hetkel luuakse hetkeline dipool ja molekulil on hetkel positiivne ja negatiivne poolus, mis põhjustab külgetõmmet. Näited: CO
2, CH4 ja BH3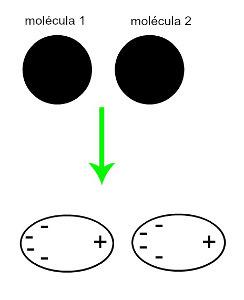
Kahe mittepolaarse molekuli lähendamine tekitab deformatsiooni ja sellest tulenevalt elektronide ümberjaotuse, mis moodustab hetkelised dipoolid
♦ Vesiniksidemed: see on molekulidevaheline jõud, mis esineb polaarmolekulides, kuid ainult nendes, kus kohustuslikult on vesiniku aatomid seotud otse fluori-, hapniku- või lämmastikuaatomitega. Seda võib pidada dipool-dipooljõuks, kuid palju suurema intensiivsusega. Koostoime toimub alati ühe molekuli vesiniku ja teise molekuli erineva aatomi (F, O, N) vahel. Näited: H2O, NH3 ja HF
Ärge lõpetage kohe... Peale reklaami on veel;)
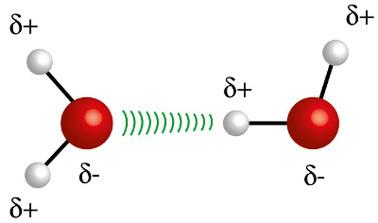
Ühe molekuli vesinikuaatom (valge kera) interakteerub teise veemolekuli hapnikuga (punane kera)
Meenutanud kolme molekulidevahelist jõudu, saame neid nüüd seostada ainete keemistemperatuuriga. kutsutakse keemispunkt temperatuur, mille juures antud aine molekulid lakkavad olemast vedelas olekus (nende molekulidevahelised jõud on purunenud) ja lülituvad gaasilisse olekusse. Huvitav detail on see, et molekulidevahelised jõud ja keemistemperatuur ainetel on väga intensiivne ja otsene seos, sest mida intensiivsem on molekulidevaheline jõud, seda kõrgem on keemistemperatuur. Molekulidevaheliste jõudude intensiivsuse järjekord on:
Indutseeritud dipool
Seega võime järeldada, et molekulidel, millel on vastasmõjuna vesiniksidemed, on kõrgemad keemistemperatuurid kui neil, millel on dipool-dipool ja nii edasi. Alltoodud tabel näitab kolme ainet ja nende keemistemperatuuri väärtusi:
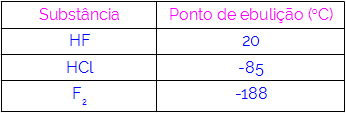
Tabelis täheldame, et HF-l on kõrgem keemistemperatuur, kuna selle molekulid on ühendatud vesiniksidemetega. F aine2 sellel on madalaim keemistemperatuur, kuna selle molekule tõmbab indutseeritud dipool.
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Molekulidevahelised jõud ja ainete keemistemperatuur"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm. Juurdepääs 27. juunil 2021.
Keemia
Molekulaarsed ained, keemistemperatuur, kokkupuutepind, keemistemperatuur, molekulidevahelised tõmbejõud, keemilised sidemed, molekulaarsed ühendid, kovalentsed keemilised sidemed, ioonsidemed, metallisidemed, halb