Sest klassifitseerige sigmalink, on oluline teada, kuidas seda molekuli struktuuris ära tunda. Sigmaside on tegelikult kovalentne side, mis tekib siis, kui kaks mittetäielikku aatomiorbiiti (ainult ühe elektroniga) läbida samal teljel. Näide on see, kui p-tüüpi (heeliks) orbitaal tungib teise p-orbiidiga.

p orbitaalid, mis läbivad p-p sigmasideme
Praktikas (harjutustes), sigmalingi tuvastamine ja klassifitseerimine toimub struktuurivalemi järgi aine koostis, nagu allpool toodud struktuurilisel esitusel:

Vesiniktsüaniidhappe struktuurivalem
Enne sigmalingi klassifitseerimist on vaja teada, kuidas seda struktuurivalemis ära tunda. Selleks pidage lihtsalt meeles viisil nagu a kovalentne side on esindatud: Kõne lihtne on tähistatud ühe kriipsuga (-), paar tähistab kaks (=) ja link kolmekordne on kolm (≡). Sigmaside on olemas kovalentsete sidemete mis tahes kolmel kujutisel järgmiselt:
Lihtne: on sigmaside;
Paar: Kahest lülist on ainult üks sigma;
Kolmekordne: Üks kolmest lülist on sigma.
Teades, kuidas sigmalinki ära tunda, on järgmine samm õppida seda järjestama. Selleks peame teadma, mis on iga sidemega seotud aatomi mittetäielik orbiit:
H - esitab mittetäieliku s orbitaali, seega on klassifikatsioonis esindatud s-ga.
Ametallid- neil on puudulik orbitaal, seega on neid klassifikatsioonis tähistatud p-ga, välja arvatud järgmised elemendid:
Süsinik: Teie mittetäielik orbitaal sõltub tüübist hübridiseerimine et ta kannatab. Võimalused on järgmised: sp hübridiseerimine3 (kui palju see teeb nelja lihtsat kõnet), sp2 (kui palju see teeb kaks ühe- ja ühte kaksiksidet) või sp (kui palju see teostab kahte kaksiksidet või ühte ühe- ja ühte kolmekordset sidet). Seega võib sigmasideme klassifitseerimisel süsinikku kujutada sp3, sp2 või sp sõltuvalt teie helistamisest.
Berüllium:kannatama sp tüüpi hübridisatsioon, seega on klassifikatsioonis tähistatud sp.
Boor:kannatama sp tüüpi hübridisatsioon2, seega on klassifikatsioonis esindatud sp.2.
Kogu selle teabe põhjal on kõige lihtsam klassifitseerida struktuuris esinevad sigmalingid. Vaatame mõningaid näiteid:
Näide 1: sigmaühendused vees

Vee struktuurivalem
Ärge lõpetage kohe... Peale reklaami on veel;)
Ülaltoodud struktuurivalem näitab, et vees on kaks sigmasidet (kaks lihtsat), olles nemad hapniku vahel (mida esindab lk) see on Vesinik (mida esindab s). Seega on meil kaks sigmalinki, mis on liigitatud:
s-p
Näide 2: Sigma seob fosfortrikloriidi

Fosfortrikloriidi struktuurivalem
Eespool toodud struktuurivalem näitab, et fosfortrikloriidil on kolm kõnetsigmasid (kolm lihtsat), olles nemad sisestage fosfor (mida esindab lk) see on kloor (mida esindab lk). Seega on meil kolm sigmalinki, mis on liigitatud:
p-p
Näide 3: sigmasidemed boortrifluoriidis
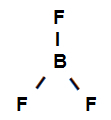
Boortrifluoriidi struktuurivalem
Eespool toodud struktuurivalem näitab, et boortrifluoriidil on kolm sigmalinki (kolm lihtsat), olles nemad sisestage boor (esindatud sp2) see on Fluor (mida esindab lk). Seega on meil kolm sigmalinki, mis on liigitatud:
p-sp2
Näide 4: sigmasidemed etanoolis
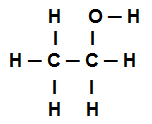
Etanooli struktuurivalem
Eespool toodud etanooli struktuurivalem näitab seda meil on kohal kaheksa kõnet sigmasid (kaheksa lihtsat linki). Kas nad on:
Üks hapniku hulgas (tähistab p) ja vesinik (mida esindab s). Seega klassifitseeritakse link sigmaks s-p.
Üks kahest süsinikust mis teostavad ainult sigmaühendusi (ja siis esindatud sp3). Seega klassifitseeritakse link sp3-P3.
Üks süsiniku hulgas (esindatud sp3) ja hapnik (mida esindab lk). Seega klassifitseeritakse sigmalink p-sp3.
viis süsiniku vahel (esindatud sp3) ja vesinik (mida esindab s). Seega liigitatakse kõik viis s-sp3.
Näide 5: Sigma seob dikloroeteeni

Dikloroeteeni struktuurivalem
Ülaltoodud dikloroeteeni struktuurivalem näitab, et meil on viis sigmalinki (neli üksiksidet ja üks kaksiksidemest). Kas nad on:
Üks kahest süsinikust mis täidavad kahte ühe- ja ühte kaksiksidet (ja siis esindatud sp2). Seega klassifitseeritakse sigmalink sp2-P2.
Neli on süsiniku vahel(esindatud sp2)ja vesinik (tähistab s). Seega liigitatakse kõik neli s-sp2.
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Sigmalingi klassifikatsioon"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm. Juurdepääs 28. juunil 2021.



