Halogeniid on orgaaniline ühend, millel on vähemalt üks halogeeniaatom. - see tähendab perioodilise tabeli perekonna 17 või VII keemilised elemendid (F, Cl, Br, I või üldiselt: X) seotud süsivesinikest tuletatud rühmaga.
RX (kus X = F, Cl, Br või I)
Mõned halogeniidid on toodud allpool:

Jood on kõigist kõige reaktsioonivõimelisem ja fluori kõige vähem, kuna halogeeni ja süsiniku vaheline sidumisenergia suureneb joodi suunast fluoriks.
Teine punkt on see, et reaktiivsus kasvab ka selles mõttes:

See reaktsioonivõime toimub tertsiaarsete süsinikhalogeniidide puhul kergemini, orgaanilise halogeniidiga seotud süsiniku omandatud omaduste tõttu:

Seega tõmbab asendusrühma, näiteks alkoholi moodustavat OH, tugevamalt tertsiaarne süsinik, millel on positiivne iseloom (1+), ja asendamine on lihtsam.
Ärge lõpetage kohe... Peale reklaami on veel;)
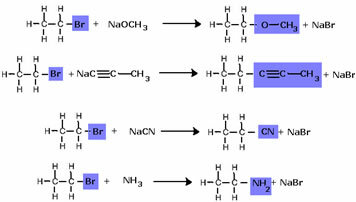
Halogeniidid võivad läbida reaktsioone, mis võimaldavad meil saada praktiliselt kõiki muid orgaanilisi funktsioone (muu hulgas alkohol, eeter, alküün, tsüaniid või nitriil, amiin). Kuid see on praktikas teostamatu, kuna halogeniidid on väga kallid ühendid.
Näiteks alkoholi saamiseks reageeritakse halogeniid vesikeskkonnas tugeva alusega, näiteks naatriumhüdroksiidiga. Vaatame allpool näidet, milles etüülkloriidi (kloroetaan) leeliselisest hüdrolüüsist moodustub etanool:
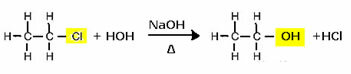
Pange tähele, et halogeniidrühm asendati alkoholi funktsionaalse rühmaga OH. Sama skeemi järgitakse ka teiste rühmade moodustamisel, eristades ainult reagenti:
Autor Jennifer Fogaça
Lõpetanud keemia
Brasiilia koolimeeskond
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Orgaanilised halogeniidide asendusreaktsioonid"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/reacoes-substituicao-haletos-organicos.htm. Juurdepääs 28. juunil 2021.