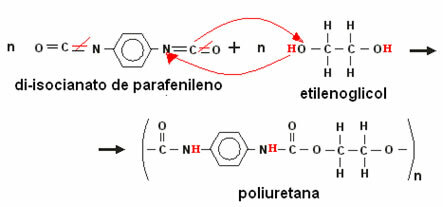
Kui analüüsime energiadiagrammil (või skeemil Pauling) on võimalik "ennustada" kahte küsimust selle aatomi elemendi asukoha kohta tabelis Perioodika: periood ja perekond.
Mõelgem kõigepealt perioodile:

Vaatleme näiteks nelja elemendi juhtumit erinevatest perioodidest:
·Ole (Z = 4): A geomeetriline järjekord berülliumi elektroonilise levitamise osakaal on: 1 s2 / 2s2.
Vaadake, et 2 taset on täidetud, nii et berüllium on pärit 2º ajakursus.
·Na (Z = 11): Naatriumi elektroonilise jaotuse geomeetriline järjestus on: 1 s2 / 2s2 2p6 / 3s1.
Sel juhul täideti 3 taset, seega on naatrium pärit 3º ajakursus.
·As (Z = 33): Arseeni elektroonilise jaotuse geomeetriline järjestus on: 1 s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s24P3.
4 taset täideti, nii et arseen pärineb 4º ajakursus.
·I (Z = 53): Joodi elektroonilise jaotuse geomeetriline järjestus on: 1 s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 4d10 / 5s25P5.
5 taset täideti, nii et jood on pärit 5º ajakursus.
Mõelgem nüüd, kuidas saaksime elementide perekonda avastada:

Vaadake, kuidas see juhtub igas ülalnimetatud elemendirühmas:
·Esindavad elemendid:
Need elemendid kuuluvad perekondadesse: 1, 2, 13, 14, 15, 16, 17 ja 18. Neid nimetatakse ka tüüpilisteks või iseloomulikeks elementideks ning veel värskendamata tabelites vastavad need veergudes A olevatele elementidele (IA, IIA, IIIA, IVA, VA, VIA, VIIA, VIII A).
Alati, kui kõige energilisem elektron on alam- või s-tasemel, on see tüüpiline element. Pealegi näitab äärmisel tasandil täidetud elektronide summa meile, milline on nende perekond.
Vaadake, kuidas see juhtub:
·1. pere: Kõigil on viimasel energiatasemel 1 elektron.
Näited:
1H: 1s1 → Vaatamata sellele, et vesinik ei ole leelismetall, ilmub vesinik perekonna 1 tabelisse, kuna selle viimases ja ainsas kestas on 1 elektron.
3Ma lugesin: 1s2 / 2s1
11In: 1s2 / 2s2 2p6 / 3s1
19K: 1s2 / 2s2 2p6 / 3s2 3p6 / 4s1
37Rb: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 / 5s1
Ärge lõpetage kohe... Peale reklaami on veel;)
55Cs: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 4d10 / 5s2 5p6 / 6s1
87Fr: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 4d10 4f14 / 5s2 5p6 5d10 / 6s2 6p6 / 7s1
Seega võime järeldada, et selle rühma elementide elektrooniline konfiguratsioon lõpeb meile1 (n = 1 kuni 7).
See aitab meil näha, et üldistamine teistele rühmadele või peredele on järgmine:
·2. pere: Kõigil neil on viimasel tasemel 2 elektroni ja elektronide konfiguratsioon lõpeb meile2.
·13. pere: Kõigil neil on viimasel tasemel 3 elektroni ja elektronide konfiguratsioon lõpeb meile2 np1.
·14. pere: Kõigil neil on viimasel tasemel 4 elektroni ja elektronide konfiguratsioon lõpeb meile2 np2.
·15. pere: Kõigil neil on viimasel tasemel 5 elektroni ja elektronide konfiguratsioon lõpeb meile2 np3.
·16. pere: Kõigil neil on viimasel tasemel 6 elektroni ja elektronide konfiguratsioon lõpeb meile2 np4.
·17. pere: Kõigil neil on viimasel tasemel 7 elektroni ja elektronide konfiguratsioon lõpeb meile2 np5.
- Välised üleminekuelemendid:
Üleminekuelemendid on need, mis on perekondades 3–12, ja välised üleminekuelemendid on need, mis on avatud (välised). Vanades tabelites hõivavad üleminekuelemendid veerud B.
Neil on elektron energilisem peal alamtase d mittetäielik. Teie elektrooniline konfiguratsioon lõpeb meile2 (n-1) d (1 kuni 8).
Vaadake kahte näidet, mille seaded on nüüd energiakorras:
28Ni: 1 s2 2s2 2p6 3s2 3p6 4s23d8
39Y: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s24d1
- Sisemised üleminekuelemendid:
Need on elemendid, mis hõivavad perioodilise tabeli 3. rühma, kuid jäävad sisemisteks ning nende nägemiseks tõmbame tabeli alla rida, mis kordab 6. ja 7. perioodi. Perioodi 6 nimetatakse lantanidi seeriaks ja perioodiks 7 on aktiiniidide seeria.

Sisemistel üleminekuelementidel on a-s kõige põhilisemas aatomis kõige energilisem elektron mittetäielik alamtase f. Teie elektrooniline konfiguratsioon lõpeb meile2 (n - 2) f (1 kuni 13).
Näide elektroonilises konfiguratsioonis toitekorras:
57La: 1s2 / 2s2 2p6 / 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f1.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Perioodiline tabel ja elementide energiadiagramm"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/tabela-periodica-diagrama-energia-dos-elementos.htm. Juurdepääs 27. juunil 2021.