THE oktetti teooria pakkus välja Newton Lewis, kes uuringutes täheldas, et aatomi interaktsioon toimub nii et iga element omandaks väärisgaasi elektroonilise stabiilsuse, see tähendab kaheksa elektroni valentsikiht. Mõnes molekulis juhtub aga okteti laienemine või kokkutõmbumine, see tähendab, et keskne aatom loob enam-vähem ennustatud sidemed.
Loe ka: Kovalentne side - klassifikatsioonid ja omadused
Kuidas oktetiteooria töötab?
Muidugi otsivad kõik süsteemid võimalust omandada võimalikult palju stabiilsustja see ei erine aatomiga. Aatomid on mis tahes aine "baasosakesed" ja nende struktuuris on elektrosfäär. See elektrosfäär jagati Linus Pauling energiatasemetel ja alatasemetel. Pauling töötas välja diagrammi, et näidata, kuidas elektronide jaotus aatomi tuuma ümber välja näeb.
Vaadake allolevat pilti:
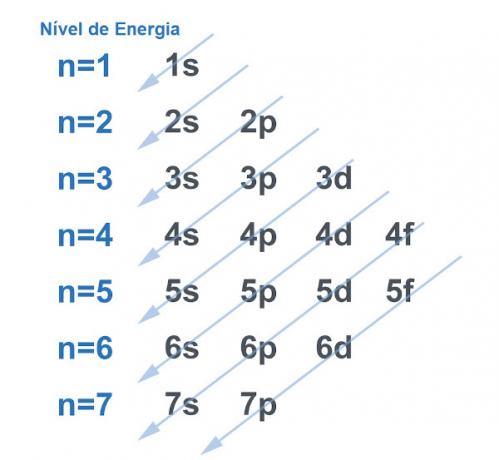
Igal tasemel ja alatasemel on summa elektronid. Analoogiat tehes võime öelda, et iga tasand on riiul ja iga alamtase on kast. Igasse kasti mahutage kaks elektroni. Aatom on stabiilne, kui kõik selle elektronid on paaritatud, see tähendab, et kui on olemas kõik kastid, milles on mõlemad kaks elektroni.
Näide:
Teeme hapniku (O) elektroonilise jaotuse, mille loomulikus olekus on kaheksa elektroni.
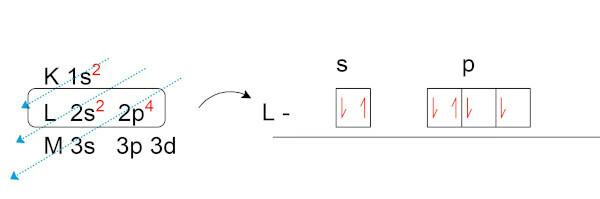
Pange tähele, et valentsikihis (L kiht p alatasemel) on meil kaks paardumata elektroni. Need elektronid loovad keemilised sidemed teiste elementidega soovides moodustada elektroonilisi paare.
Oktettiteooria põhineb elektronide liitmise matemaatikal. Kui viimase elektronkesta kõigil alamtasemetel on mõlemal kaks elektroni, on valentskooril kokku kaheksa elektroni ja järelikult on aatom stabiilne.
Loe ka: Kvantarvud - elektronide energiaga seotud arvud
Ärge lõpetage kohe... Peale reklaami on veel;)
väärisgaasid
Ainult väärisgaasid on võib looduses leida monoatoomilises vormissee tähendab ilma teise aatomiga sidet loomata. Seda seetõttu, et neil on elektrooniline stabiilsus. Peaaegu kõigil neist on valentskoores kaheksa elektroni., järgides oktetti reeglit, välja arvatud heeliumgaas, millel on ainult kaks elektroni.

Erandid oktettiteooriast
Mõned ühendid suudavad stabiliseeruda, valentskoores on rohkem kui vähem kui kaheksa elektroni. Nendel juhtudel ilmnevad oktettiteoorias erandid.
okteti laiendamine
See juhtub peamiselt fosfori (P) ja väävli (S) puhul, mis on suhteliselt suured aatomid ja millel on alamtase “d”. Sellisel juhul hoiab aatom oma viimases kestas üle kaheksa elektroni.
Näide:
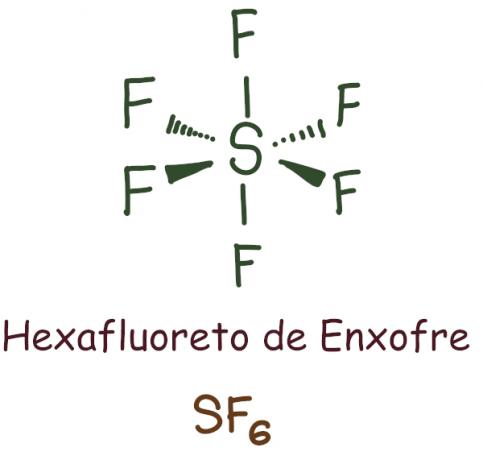
Väävelheksafluoriidi puhul jäi keskne element alles 12 elektroni, mis ületab 8, mis on vajalik oktetti reegli järgi stabiliseerumiseks. Sel juhul toimus okteti laienemine.
oktetti kokkutõmbumine
Juhtub berülliumi (Be), boori (B) ja mõnega oksiidid lämmastikku. Vaadake näidet:
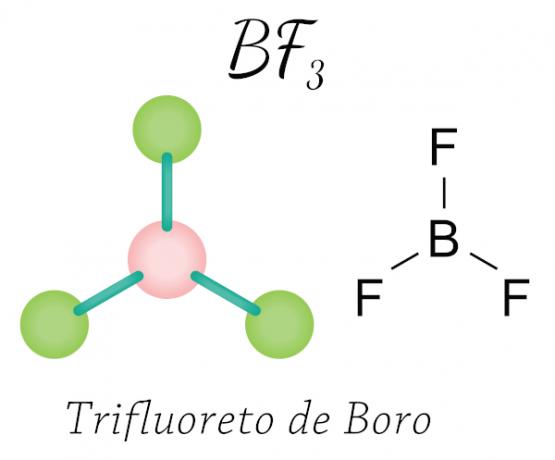
Booritrifluoriidi korral omandavad fluori aatomid valentskihis vajalikud kaheksa elektroni, jagades neid booriga elektrooniline, austades oktetti reeglit, kuid keskaatom (boor) ei stabiliseeru kuue elektroniga, nii et see toimub üks okteti kokkutõmbumine.
Juurdepääs ka: Sigmalingi klassifitseerimine: millised on kriteeriumid?
lahendatud harjutused
küsimus 1 - (Mackenzie-SP) Väävel- ja kaaliumiaatomite elektroonilise konfiguratsiooni saamiseks väärisgaasiga on vajalik, et:
(Andmed: aatomnumber S = 16; K = 19)
A) väävel saab 2 elektroni ja kaalium 7 elektroni.
B) väävel annab 6 elektroni ja kaalium 7 elektroni.
C) väävel annab 2 elektroni ja kaalium 1 elektroni.
D) väävel saab 6 elektroni ja kaalium loobub 1 elektronist.
E) väävel saab 2 elektroni ja kaalium loobub 1 elektronist.
Resolutsioon
Alternatiiv E. Väävel on veeru 16 või perekonna 6A element. Selle perekonna elemendid võtavad elektrooniliste paaride moodustamiseks vastu kaks elektroni ja valentskoores on kokku kaheksa elektroni. 1A perekonna elementidel, milleks on leelismetallid, on valentskoores ainult üks elektron. Selle elektroni annetamisel saab eelmisest kihist juba kaheksa elektroniga valentsikiht, nagu dikteerib okteti reegel.
2. küsimus - Hinnake järgmisi väiteid tõene (T) või vale (F).
I () Oktetireegel ütleb, et valendi kestas on vaja kaheksat elektroni, et aatom oleks stabiilne.
II () Valentsikiht on aatomi teine elektrooniline kiht.
III () Halogeenide perekonnast pärinev kloor (Cl) kipub stabiilsuse saamiseks omandama kaks elektroni.
IV () 1A perekonna element naatrium (Na) kipub kaotama ainsat valentskoore elektroni.
Märkige õige alternatiiv:
A) I, III ja IV vastavad tõele.
B) I ja IV vastavad tõele.
C) Ainult II vastab tõele.
D) Vale on ainult IV.
E) Kõik on tõesed.
Resolutsioon
Alternatiiv B. I ja IV vastavad tõele. Väide II on vale, kuna valentsikiht on aatomi viimane, mitte teine elektronkiht. Ja III väites öeldakse, et klooril on kalduvus omandada kaks elektroni, mis ei kontrolli, kuna kloor on pärit 7A või 17 perekond, omandab gaasi elektroonilise konfiguratsiooni saamiseks ainult ühe elektroni üllas.
Autor Laysa Bernardes Marques de Araújo
Keemiaõpetaja