THE entalpia (H) seda saab määratleda iga materjali energiasisalduse või süsteemi koguenergiana. Praktikas ei ole siiski võimalik aine entalpiat määrata. Niisiis, mida tavaliselt mõõdetakse, on entalpia variatsioon 

Analüüsime siin entalpia varieerumist eksotermilistes reaktsioonides (sõna “exo” tuleb kreeka keelest ja tähendab “välja, välja, välja”), mis on need reaktsioonid, milles toimub soojuse eraldumine. Igapäevaelus on nende reaktsioonide kohta palju näiteid, näiteks põlemine ja kustutamata lubja segu veega.
Nendel juhtudel entalpia variatsioon 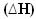 on täpselt eralduv soojushulk, mis on antud lõpliku entalpia väärtusest, millest lahutatakse algne entalpia (Hf - Hi) või reaktsioonina saaduste entalpia väärtus miinus reagentide väärtus (HP - HR).
on täpselt eralduv soojushulk, mis on antud lõpliku entalpia väärtusest, millest lahutatakse algne entalpia (Hf - Hi) või reaktsioonina saaduste entalpia väärtus miinus reagentide väärtus (HP - HR).
Soojuse eraldumisel kaob energia. Seega väheneb süsteemi koguenergia, nii et toodete entalpia on alati madalam kui reaktiivide sisaldus, nii et entalpia variatsioon eksotermilistes reaktsioonides on alati negatiivne, väiksem kui null 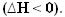
Ärge lõpetage kohe... Peale reklaami on veel;)
Arvestades üldist eksotermilist reaktsiooni:
| A → B + kuumus |
Seda saab väljendada allpool toodud entalpia diagrammiga:
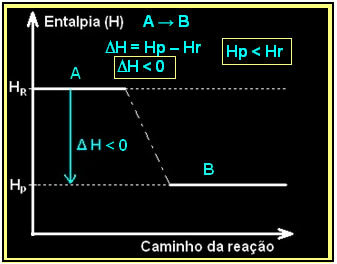
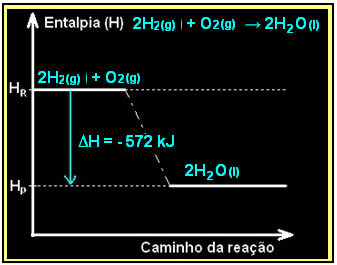
Vesinikgaasi põlemine koos vedeliku moodustumisega toimub koos energia vabanemisega. Süsteemi entalpia variatsiooni väärtus selles reaktsioonis antakse järgmiselt:
2h2 g) + O2 g) → 2H2O(1)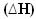 = - 572 kJ
= - 572 kJ
Teie skeem oleks kujutatud järgmiselt:
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Entalpia varieerumine eksotermilistes reaktsioonides"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/variacao-entalpia-reacoes-exotermicas.htm. Juurdepääs 28. juunil 2021.
Keemia

Termokeemia, entalpia, eralduv soojus, eksotermiline reaktsioon, põlemisreaktsioon, väliskeskkond, endotermiline reaktsioon, reaktsioon keemia, energiavahetus, reaktiivid, valguse kiirgus, valguse neeldumine, soojus, elekter, komponendid, füüsikaline olek, tooted.