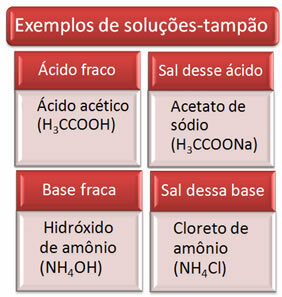
La solución tampón suele ser una mezcla de un ácido débil y una sal de ese ácido, o una base débil y una sal de esa base. Esta solución está destinada a evitar que se produzcan variaciones muy grandes en el pH o pOH de una solución.
A continuación se muestran algunos ejemplos de soluciones tampón:
La eficacia de la solución tampón se puede ver en nuestra sangre, donde, incluso con la adición de ácido o base en pequeñas cantidades al plasma sanguíneo, prácticamente no hay cambio en su pH.
¿Cómo sucede esto, dado que si agregamos ácidos o bases al agua, su pH cambia rápidamente?
La sangre humana es un sistema tampón ligeramente básico, es decir, es un líquido tamponado: su pH se mantiene constante entre 7,35 y 7,45. Uno de los tampones más interesantes e importantes de la sangre lo forma el ácido carbónico (H2CO3) y por la sal de este ácido, bicarbonato de sodio (NaHCO3).
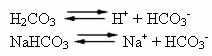
Por lo tanto, existen las siguientes especies en esta solución tampón:
H2CO3: presente en grandes cantidades, al ser un ácido débil, sufre poca ionización;
H+: de la ionización de H2CO3;
HCO3-: también presente en grandes cantidades, a partir de la ionización de H2CO3 y la disociación de la sal (NaHCO3);
A+: de la ionización de NaHCO3;
No pares ahora... Hay más después de la publicidad;)
Si se agrega una pequeña concentración de ácido a esta solución, se producirá su ionización, generando cationes H+, que reaccionará con aniones HCO3- presente en el medio, originando ácido carbónico no ionizado. No hay cambios en el pH.
Si se agrega una base, se generarán aniones OH-. Estos iones se combinan con los cationes H+, de la ionización de H2CO3. Por lo tanto, los aniones OH- se neutralizan, manteniendo el pH del medio.
Además de esta solución tampón mencionada, también hay otras dos presentes en la sangre, que son: H2POLVO4/HPO42- y algunas proteínas. Si no hubiera tales soluciones tampón en la sangre, el rango de pH podría estar seriamente sesgado. Si el pH de la sangre se eleva por encima de 7,8, se denomina alcalosis. Si el pH baja demasiado, por debajo de 6,8, será un estado de acidosis. Ambas son condiciones peligrosas que pueden provocar la muerte.

Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Solución tampón en sangre humana"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/solucaotampao-no-sangue-humano.htm. Consultado el 28 de junio de 2021.