La cantidad de calorías depende de la constitución del alimento. Entonces, para determinar experimentalmente la cantidad de calor liberado por la comida y que puede ser absorbido por el cuerpo, usamos un dispositivo llamado calorímetro.
Este dispositivo mide el calor liberado por la comida cuando se quema. Hay varios tipos de calorímetros; el primero de ellos fue creado en 1780 por Lavoisier y Laplace y fue un calorímetro de hielo.
Hoy en día, el más utilizado y que tiene en cuenta el concepto de calorías explicado anteriormente es el calorímetro de agua. Este dispositivo está cubierto con un material aislante para evitar la pérdida de calor del medio; y el alimento a analizar se coloca en el cámara de combustión, que contiene oxígeno gaseoso y electrodos. Estos electrodos sufren una descarga eléctrica y provocan su ignición y combustión de los alimentos.
La masa conocida de agua contenida en el calorímetro absorbe el calor liberado por los alimentos quemados y un termómetro mide el aumento de la temperatura del agua. Además, el calorímetro contiene un
agitador lo que permite que la temperatura del agua se mantenga uniforme en su totalidad.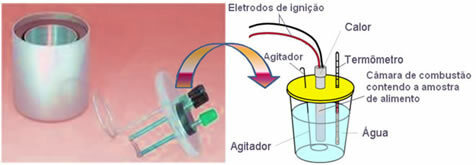
Entonces, si usamos, por ejemplo, una masa de 1 gramo de azúcar y el calorímetro tiene 1000 g de agua, y observamos que al final de la reacción, la temperatura del agua pasó de 20 ° C a 24 ° C, es decir, se incrementó en 4 ° C, entonces podemos alcanzar el valor energético del azúcar. ¿Como? Bueno, considerando el concepto de calorías inicial, tenemos:
| Aumentar de 1 ° C → 1 cal por gramo de agua |
| Aumentar de 4 ° C → 4 cal por gramo de agua |
Entonces 1 g de agua absorbe 4 cal. Sin embargo, se utilizaron 1000 g de agua y, considerando que todo el calor liberado en la combustión fue absorbido por ésta, la energía total absorbida por el agua fue de 4000 cal o 4 kcal. Por tanto, concluimos que:
| El valor energético del azúcar = 4000 cal / go 4 kcal / g. |
Transformarse al SI:
1 kcal 4,18 kJ
4 kcal / g x
x = 16,72 kJ / g
Además, podemos utilizar la siguiente ecuación para calcular la cantidad de calor cedida o absorbida por el agua:
| Q = m. C. t |
Dónde:
Q = calor desprendido o absorbido por el agua;
m = masa de agua;
c = calor específico del agua, que equivale a 1,0 cal / g. ° C o 4,18 J / g. ° C;
Δt = variación de la temperatura que sufre el agua, que viene dada por la disminución de la temperatura final por la inicial (tF - tI).
Usando esta fórmula obtenemos el mismo resultado:
Q = m. C. t
Q = 1000 g. 1,0 cal / g. ° C. (24-20) ° C
Q = 4000 cal
Q = 4.0 kcal
o
Q = m. C. t
Q = 1000 g. 4,18 kJ / g. ° C. (24-20) ° C
Q = 16,72 kJ
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/medindo-as-calorias-dos-alimentos-por-meio-um-calorimetro.htm