En el texto "Título o porcentaje de masa”Vimos cómo calcular la relación entre la masa del soluto y la masa de la solución, para soluciones sólidas, líquidas y gaseosas. En este texto, sin embargo, veremos que también es posible calcular el título en términos de volumen, para soluciones con componentes líquidos o gaseosos.

El título en volumen se puede calcular mediante la expresión:
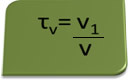
Considere como ejemplo una solución acuosa de alcohol etílico utilizada como antiséptico y desinfectante, que fue preparado agregando 70 mL de alcohol puro a suficiente agua para completar un volumen de 100 mL de solución. Entonces tenemos:
τ = 70 ml = 0,7
100ml
También podemos expresar el título en porcentaje, simplemente multiplicando el resultado por 100%. Entonces, en este caso tenemos una solución de alcohol etílico al 70%, lo que significa que de cada 100 unidades de volumen de la solución, 70 unidades de volumen son alcohol.
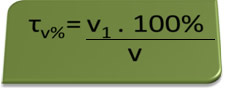
En el caso siguiente, tenemos una solución de alcohol etílico al 70% en un volumen de solución de 250 mL; lo que significa que 175 mL son alcohol, según los cálculos:
100 mL 70 mL de alcohol
250 ml x
x = 70. 250
100
X = 175 mL de alcohol

Sin embargo, no podemos decir que en este caso tengamos 75 mL (250-175) de agua. A diferencia del título de masa, en el que podemos sumar la masa del disolvente a la masa del soluto para encontrar la masa de la solución, esto no se puede hacer en relación con el título de volumen.

Esto significa que el volumen de la solución no es igual a la suma del volumen del disolvente y el volumen del soluto (aunque a menudo la diferencia puede considerarse insignificante). Esto se debe a que las fuerzas intermoleculares que existen en estos líquidos influyen en el volumen final.
En el caso de la solución antes mencionada, de alcohol etílico, por ejemplo, cuando mezclamos alcohol con agua, se produce una contracción del volumen total de la solución; es decir, el volumen final será menor que si añadiéramos solo el volumen de alcohol y agua. Esto se debe a que las moléculas de alcohol establecen enlaces o enlaces de hidrógeno con las moléculas de agua, reduciendo los espacios entre ellas.
Por lo tanto, en este y otros casos, el volumen de la solución debe medirse experimentalmente cuando no se proporciona en el ejercicio.
El porcentaje en volumen es muy utilizado en los casos de bebidas alcohólicas y alcohol comercial, como se mencionó anteriormente. Vea dos aplicaciones importantes de este cálculo:
- Alcoholímetro: el alcoholímetro mide la concentración de alcohol etílico en la sangre, y en Brasil está prohibido conducir cualquier tipo de vehículo con un contenido de alcohol en sangre igual o superior al 0,1% en volumen. Una persona con este contenido de alcohol tiene, por cada litro de sangre, 1 mL de alcohol, como muestran los siguientes cálculos:
τv%=V1. 100%
v
0,1 % = V1. 100%
1 litro
V1 = 0,1% → V1 = 0.001 L = 1 mL
100%

- Contenido de etanol en gasolina: en Brasil, la gasolina está regulada por la adición de etanol. Pero el contenido de etanol en la gasolina debe ser como máximo del 24% en volumen de alcohol anhidro (ya que la gasolina debe estar libre de agua). Cuanto más etanol se agrega a la gasolina, más se aclara el color del combustible y aumenta su densidad.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm
