tenemos una mezcla de soluciones con diferentes solutos sin reacción química cuando dos o más mezclas que tienen sustancias con el mismo ion en común (ya sea el mismo catión o el mismo anión). Como en el ejemplo siguiente:
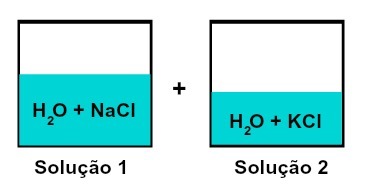
Mezcla de soluciones que tienen diferentes solutos.
La solución 1 es agua y cloruro de sodio (NaCl), mientras que la solución 2 tiene agua y cloruro de potasio (KCl). Cuando se mezclan tenemos un Mezcla de diferentes soluciones de solutos sin reacción química., porque ambas sales utilizadas tienen el anión cloruro (Cl-).
1- Características de mezclas de diferentes soluciones de solutos sin reacción química
Cuando se lleva a cabo una mezcla de soluciones que tienen diferentes solutos sin reacción química, siempre se comprueban las siguientes características:
La masa de cada uno de los solutos no cambia (si en la solución 1 tenemos 10 g de soluto y en 2, 30 g, por ejemplo, después de mezclar tendremos la misma masa de cada soluto),
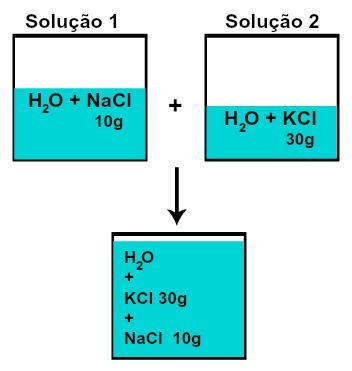
Masa de cada uno de los solutos después de mezclar soluciones sin reacción química
LA Cantidad de materia (n) de cada uno de los solutos no cambia (si en la solución 1 tenemos 5 mol de soluto y en 2, 4 mol, por ejemplo, después de mezclar tendremos la misma cantidad de materia de cada uno),
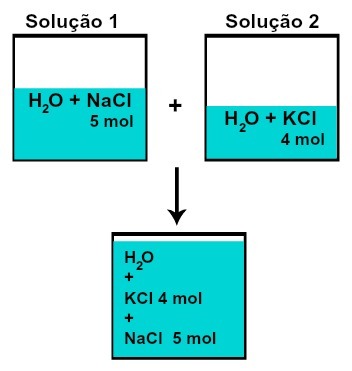
Número de moles de cada uno de los solutos después de mezclar soluciones sin reacción química
El volumen de la solución final, VF, es el resultado de la suma de los volúmenes de cada una de las soluciones mezcladas (si en la solución 1 tenemos 200 mL y en la solución 2, 300 mL, por ejemplo, después de mezclar tendremos 500 mL de volumen),
VF = V1 + V2
2- Fórmulas utilizadas en los cálculos de mezcla de soluciones de diferentes solutos sin reacción química.
Como en este tipo de mezclas solo tenemos un aumento en la cantidad de solvente en relación a cada uno de los solutos, debemos calcular la concentración final de cada uno de los solutos usando el siguiente expresiones:
a) Para concentración común (C)
Para la solución 1: la multiplicación de la concentración de la solución 1 por su volumen es igual a la concentración final multiplicada por su volumen.
C1.V1 = CF.VF
Para la solución 2: la multiplicación de la concentración de la solución 2 por su volumen es igual a la concentración final multiplicada por su volumen.
C2.V2 = CF.VF
b) Para concentración en cantidad de materia o molaridad (METRO)
Para la solución 1:
METRO1.V1 = MF.VF
Para la solución 2:
METRO2.V2 = MF.VF
c) Concentración en cantidad de materia de cada ion presente en la solución
Si tenemos que determinar la concentración de uno o todos los iones presentes en la solución final, debemos:
1º: Recuerde que la concentración de iones viene dada por la multiplicación de la concentración (M), del soluto del que proviene, por su índice en la fórmula de la sustancia. Entonces, para el ion Y, en la sustancia 1, XY3, la concentración será:
[Y]1 = 3. METRO
En cuanto al soluto2, ZY, la concentración de Y vendría dada por:
[Y]2 = 1. METRO
2º: Si tenemos más de un soluto que libera el mismo ion, por ejemplo, los solutos XY3 y ZY, que tienen el mismo ion Y, la concentración de este ion en la solución final viene dada por la suma de sus concentraciones para cada soluto:
[Y]F = [Y]1 + [Y]2
3- Ejemplos de cálculos que involucran la mezcla de soluciones de diferentes solutos sin reacción química.
Ejemplo 1: (PUC SP) En un vaso de precipitados se mezclaron 200 mL de una solución acuosa de cloruro de calcio (CaCl)2) de 0,5 mol de concentración. L–1 y 300 ml de una solución de 0,8 moles. L–1 de cloruro de sodio (NaCl). La solución obtenida tiene una concentración de anión cloruro de aproximadamente:
a) 0,34 mol. L–1
b) 0,65 mol. L–1
c) 0,68 mol. L–1
d) 0,88 mol. L–1
e) 1,3 mol. L–1
Los datos proporcionados por el ejercicio fueron:
Solucion 1:
Volumen (V1): 200 ml
Concentración molar (M1): 0,5 mol. L–1
Solucion 2:
Volumen (V2): 300 ml
Concentración molar (M2): 0,8 mol. L–1
Para determinar la concentración de aniones cloruro (Cl-), debemos seguir estos pasos:
Paso 1: calcular el volumen de la solución final
VF = V1 + V2
VF = 200 + 300
VF = 500 ml
Paso 2: Calcule la concentración molar de la solución final con respecto al soluto de CaCl2, usando la siguiente expresión:
METRO1.V1 = MF.VF
0.5.200 = MF.500
100 = MF.500
100 = METROF
500
METROF = 0,2 mol. L–1
Paso 3: Calcule la concentración molar de cloruro [Cl-]1, en la solución final, del soluto de CaCl2, usando la siguiente expresión:
NOTA: En la fórmula tenemos la multiplicación de la molaridad por 2 porque tenemos el índice 2 en Cl, en la fórmula de soluto CaCl2.
[Cl-]1 = 2.MF
[Cl-]1 = 2. 0,2
[Cl-]1 = 0,4 mol. L–1
Paso 4: Calcule la concentración molar de la solución final con respecto al soluto de NaCl, usando la siguiente expresión:
METRO2.V2 = MF.VF
0,8,300 = MF.500
240 = MF.500
240 = MF
500
METROF = 0,48 mol. L–1
Paso 5: Calcule la concentración molar de cloruro, [Cl-]2, en la solución final, del soluto de NaCl, usando la siguiente expresión:
NOTA: En la fórmula tenemos la multiplicación de la molaridad por 1 porque tenemos el índice 1 en Cl, en la fórmula para el soluto NaCl.
[Cl-]2 = 1.MF
[Cl-]2 = 1. 0,48
[Cl-]2 = 0,48 mol. L–1
Paso 6: Calcule la cantidad total de iones cloruro en la solución final.
Para hacer esto, simplemente agregue las concentraciones molares de cloruros para cada uno de los solutos en los pasos 3 y 5:
[Cl-]F = [Cl-]1+ [Cl-]2
[Cl-]F = 0,4 + 0,48
[Cl-]F = 0,88 mol. L–1
Ejemplo 2: A una solución de 500 ml de KOH 6 mol / L se le añadieron 300 ml de solución de K.2SOLO3 3 mol / L. ¿Cuál es la concentración de cada uno de los solutos en la mezcla resultante?
a) 3,75 y 3,0 mol / L
b) 3,75 y 1,215 mol / L
c) 4.5 y 1.125 mol / L
d) 3,75 y 1,125 mol / L
e) 4.5 y 1.215 mol / L
Los datos proporcionados por el ejercicio fueron:
Solucion 1:
Volumen (V1): 500 ml
Concentración molar (M1): 6 mol. L–1
Solucion 2:
Volumen (V2): 300 ml
Concentración molar (M2): 3 mol. L–1
Para determinar la concentración de aniones cloruro (Cl-), debemos seguir estos pasos:
Paso 1: calcular el volumen de la solución final
VF = V1 + V2
VF = 500 + 300
VF = 800 ml
Paso 2: Calcule la concentración molar de la solución final con respecto al soluto de KOH, usando la siguiente expresión:
METRO1.V1 = MF.VF
6.500 = MF.800
3000 = MF.800
3000 = METROF
800
MF = 3,75 mol. L–1
Paso 3: Calcule la concentración molar de la solución final en relación con el soluto K2SOLO3, usando la siguiente expresión:
METRO2.V2 = MF.VF
3.300 = MF.800
900 = MF.800
900 = MF
800
METROF = 1,125 mol. L–1
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm
